
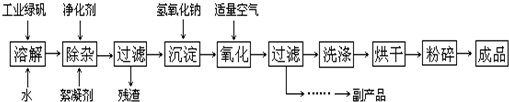
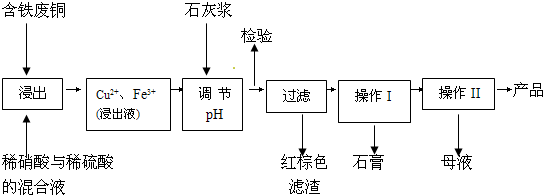
��11�֣�����ͭ��һ��Ӧ�ü���㷺�Ļ���ԭ�ϣ�������ij�����ú�����ͭΪԭ������������CuSO4��5H2 O��������ʯ�ࣨCaSO4��2H2O������������ʾ��ͼ��
������ʯ���ڲ�ͬ�¶��µ��ܽ�ȣ�g/100gˮ�����±���
| �¶�( | 20 | 40 | 60 | 80 | 100 |
| ʯ�� | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| ���� | 32 | 44.6 | 61.8 | 83.8 | 114 |
��ش��������⣺
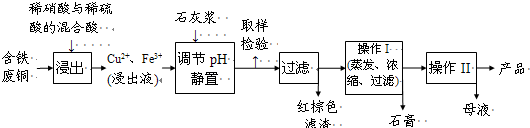
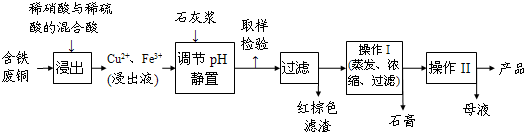
��1������ɫ��������Ҫ�ɷ��� ��
��2��д��������������������ͭ�����ӷ���ʽ ��
��3������I��������Ũ���� �Ȳ������¶�Ӧ�ÿ�����  C���ң�
C���ң�
��4������Һ�з��������ͭ����IJ�����ӦΪ �� ��ϴ�ӡ������������ˮ�Ҵ���ϴ��Һ����������ˮ��ԭ���� ������ʱ�������ɣ����ü��Ⱥ�ɵ�ԭ���� ��
��5��ȡ��������Ϊ��ȷ��Fe3+�Ƿ��������ͬѧ������������ַ�������ʵ���ҷֱ����ȡ��Ʒ�����з������в�����
����һ��ȡ�����Թܡ��μ�KSCN��Һ�� ��������ֽ��������KSCN��Һ��
������Ϊ�������ַ�����Ƹ��������� ��
��ָ������Ϊ�������������ڵ������� ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| �¶ȣ��棩 | 20 | 40 | 60 | 80 | 100 |
| ʯ�� | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| ���� | 32 | 44.6 | 61.8 | 83.8 | 114 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶ȣ��棩 | 20 | 40 | 60 | 80 | 100 |
| ʯ�� | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| ���� | 32 | 44.6 | 61.8 | 83.8 | 114 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶ȣ��棩 | 20 | 40 | 60 | 80 | 100 |
| ʯ�� | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| ���� | 32 | 44.6 | 61.8 | 83.8 | 114 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
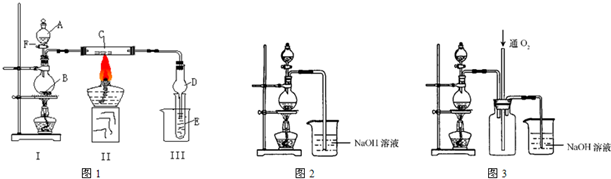
 ����ͭ��һ��Ӧ�ü���㷺�Ļ���ԭ�ϣ�ͭ������ϡ����ֱ�ӷ�Ӧ����ʵ���н�����Ũ����ֶ�μ��뵽ͭ����ϡ����Ļ�����У�����ʹ֮��Ӧ��ȫ��ͨ���������ᾧ�õ�����ͭ���壨װ����ͼ��ʾ����
����ͭ��һ��Ӧ�ü���㷺�Ļ���ԭ�ϣ�ͭ������ϡ����ֱ�ӷ�Ӧ����ʵ���н�����Ũ����ֶ�μ��뵽ͭ����ϡ����Ļ�����У�����ʹ֮��Ӧ��ȫ��ͨ���������ᾧ�õ�����ͭ���壨װ����ͼ��ʾ����| ������ | Fe��OH��3 | Cu��OH��2 | Fe��OH��2 | ��ʼ����pH | 2.7 | 4.8 | 7.6 | ��ȫ����pH | 3.7 | 6.4 | 9.6 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com