以煤为原料,经化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H
2O(g)?CO(g)+H
2(g)△H=+131.3kJ?mol
-1①该反应在高温下
能
能
自发进行(填“能”或“不能”)
②恒温下,在容积不变的密闭容器中,进行如上可逆反应.一段时间后,下列物理量不发生变化时,能表明该反应已达到平衡状态的是:
D
D
.
Ⅰ混合气体的密度;Ⅱ容器内气体的压强;Ⅲ混合气体的总物质的量,ⅣCO物质的量浓度
A.只有Ⅳ.
B只有Ⅰ和Ⅳ
C.只有Ⅱ和Ⅲ
D.只有Ⅰ、Ⅱ、Ⅲ和Ⅳ
(2)水煤气再进一步反应可制取氢气.反应为H
2O(g)+CO(g)?H
2(g)+CO
2(g),某温度下该反应的平衡常数K=4/9.该温度下在甲、乙、丙三个恒温密闭容器中,只投入H
2(g)和CO
2(g),其起始浓度下表所示.下列判断不正确的是
C
C
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)/mol/L |
0.010 |
0.020 |
0.020 |
| c(CO2)/mol/L |
0.010 |
0.010 |
0.020 |
A.反应开始时,丙中的反应速率最快,甲中的反应最慢
B.平衡时甲中和丙中的H
2的转化率均是60%
C.平衡时,丙中的c(CO
2)是甲中的2倍,是0.102mol/L
D.平衡时,乙中的CO
2的转化率大于60%
(3)目前工业上有一种方法是用CO
2来制取甲醇.一定条件下发生反应:CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g),下图表示该反应进行过程中能量(单位为kJ?mol
-1)的变化.在体积为1L的恒容密闭容器中,冲入1molCO
2和3molH
2反
①下列措施中能使平衡混合物中c(CH
3OH))增大的是
CD
CD
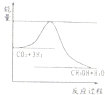
A.升高温度
B.冲入He(g)使体系压强增大
C.将H
2O(g)从体系中分离出来
D.再冲入1molCO
2和3molH
2②在温度T
1时,当反应达到平衡时,测得n(H
2)=2.4mol;其他条件不变,在温度T
2时,当反应达到平衡时,测得n(CO
2)=0.82mol,则得T
1>
>
T
2(填“>”、“<”或“=”)
(4)在一定条件下科学家从烟道气中分离出CO
2与太阳能电池电解水产生的H
2合成甲醇(常温下为液体).CH
3OH、H
2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.5kJ/mol
①写出工业上以CO
2、H
2合成CH
3OH和液态水的热化学方程式:
CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-131.9kJ/mol
CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-131.9kJ/mol
②该转化的积极意义是
可降低温室效应和弥补资源短缺
可降低温室效应和弥补资源短缺
有人提出,可以设计反应CO
2=C+O
2(△H>0、△S<0)来消除CO
2对环境的影响.请你判断是否可行并说出理由:
不可行,该反应是一个焓增、熵减的反应,所以不能自发进行
不可行,该反应是一个焓增、熵减的反应,所以不能自发进行
.

 nB(g)+nC(g)达平衡后,保持温度不变,将容器的容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍,则()。
nB(g)+nC(g)达平衡后,保持温度不变,将容器的容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍,则()。 阅读快车系列答案
阅读快车系列答案


 向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有: KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.
KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.

