分析:已知A是有机羧酸盐,B、C、D是常见化合物; A、B、C、D焰色反应呈黄色,水溶液均呈碱性.则可推知化合物A、B、C、D均为含有Na元素的碱或强碱弱酸
盐,B的碱性最强,则B为NaOH;X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同,则X、Y应为H
2O和CO
2;由C受热分解得到Y、D和X;B与C反应生成D和X,可推知C为NaHCO
3,D为Na
2CO
3;即2NaHCO
3Na
2CO
3+CO
2↑+H
2O; NaHCO
3+NaOH=Na
2CO
3+H
2O;由此可确定X为H
2O,Y为CO
2;由有机羧酸盐A与NaOH等物质的量反应生成Na
2CO
3和一种气体单质,可联想到由无水醋酸钠与NaOH加热反应制取甲烷的脱羧反应:CH
3COONa+NaOH
Na
2CO
3+CH
4↑,由此迁移可知,A为甲酸钠(HCOONa),与等物质的量NaOH进行脱羧反应生成Na
2CO
3和氢气:E由两种元素组成,式量为83,将E投入H
2O中得到NaOH和气体Z,Z在标准状况下的密度为0.76g?L
-1.由计算可知气体Z的相对分子质量是17,则Z为NH
3,由该反应:E+H
2O→NaOH+NH
3↑,可推知E由Na和N两种元素组成,再根据元素化合价可确定E是Na
3N,由此可解答问题.
解答:
解:已知A是有机羧酸盐,B、C、D是常见化合物; A、B、C、D焰色反应呈黄色,水溶液均呈碱性.则可推知化合物A、B、C、D均为含有Na元素的碱或强碱弱酸
盐,B的碱性最强,则B为NaOH;X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同,则X、Y应为H
2O和CO
2;由C受热分解得到Y、D和X;B与C反应生成D和X,可推知C为NaHCO
3,D为Na
2CO
3;即2NaHCO
3Na
2CO
3+CO
2↑+H
2O; NaHCO
3+NaOH=Na
2CO
3+H
2O;由此可确定X为H
2O,Y为CO
2;由有机羧酸盐A与NaOH等物质的量反应生成Na
2CO
3和一种气体单质,可联想到由无水醋酸钠与NaOH加热反应制取甲烷的脱羧反应:CH
3COONa+NaOH
Na
2CO
3+CH
4↑,由此迁移可知,A为甲酸钠(HCOONa),与等物质的量NaOH进行脱羧反应生成Na
2CO
3和氢气:E由两种元素组成,式量为83,将E投入H
2O中得到NaOH和气体Z,Z在标准状况下的密度为0.76g?L
-1.由计算可知气体Z的相对分子质量是17,则Z为NH
3,由该反应:E+H
2O→NaOH+NH
3↑,可推知E由Na和N两种元素组成,再根据元素化合价可确定E是Na
3N;
(1)上述分析可知A的化学式是 HCOONa;Y的电子式是
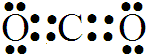
,
故答案为:HCOONa;
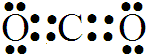
;
(2)X巍峨H
2O的沸点比同主族同类型物质要高的原因是:水分子间存在氢键,从而使分子间作用力增加,因此有较高的沸点,
故答案为:水分子间存在氢键;
(3)E为Na
3N与足量盐酸反应的化学方程式:Na
3N+4HCl=3NaOH+NH
4Cl,故答案为:Na
3N+4HCl═3NaCl+NH
4Cl;
(4)D为Na
2CO
3的饱和溶液中不断通入通Y为CO
2,析出C为NaHCO
3,反应的离子方程式为:2Na
++CO
32-+H
2O+CO
2=2NaHCO
3↓,故答案为:2Na
++CO
32-+H
2O+CO
2=2NaHCO
3↓;
(5)根据2A→P+H
2↑得到P,可知,2HCOONa→Na
2C
2O
4+H
2↑,P为Na
2C
2O
4,C
2O
42-+Ca
2+=CaC
2O
4↓,依据Ksp(CaC
2O
4)=c(Ca
2+)?c(C
2O
42-)=2.3×10
-9,可计算出当CaC
2O
4完全沉淀时,溶液中Ca
2+的物质的量浓度至少为c(Ca
2+)=
mol/L=2.3×10
-4mol/L,
故答案为:2.3×10
-4mol?L
-1;
(6)实验室Na
2C
2O
4与足量HCl反应可得到H
2C
2O
4,H
2C
2O
4在浓硫酸条件下共热分解生成CO、CO
2、H
2O ( 即 H
2C
2O
4 CO↑+CO
2↑+H
2O ).设计证明分解产物中存在还原性气体CO的实验为:将所得气体先通过足量NaOH溶液(或通过盛有固体NaOH的干燥管),再通过澄清石灰水,若无现象,点燃剩余气体,将事先用澄清石灰水润湿过的烧杯倒置在火焰上方,烧杯内壁变浑浊,说明有还原性气体CO的存在,
故答案为:将所得气体先通过足量NaOH溶液,再通过澄清石灰水,无现象,点燃剩余气体,将事先用澄清石灰水润湿过的烧杯倒置在火焰上方,烧杯内壁变浑浊,说明有还原性气体CO的存在.

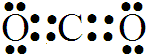 ,
,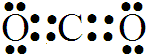 ;
;

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
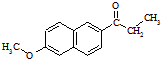 )外,最可能生成的副产物(与G互为同分异构体)的结构简式为
)外,最可能生成的副产物(与G互为同分异构体)的结构简式为 )的衍生物X是C的同分异构体,分子中含有2个取代基,且取代基在同一个苯环上;X在NaOH溶液中完全水解后,含萘环的水解产物的核磁共振氢谱有5个峰.写出X可能的结构简式:
)的衍生物X是C的同分异构体,分子中含有2个取代基,且取代基在同一个苯环上;X在NaOH溶液中完全水解后,含萘环的水解产物的核磁共振氢谱有5个峰.写出X可能的结构简式: 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).

