
分析 Ⅰ.(1)醋酸为弱酸,硫酸为二元强酸,盐酸为一元强酸,同pH时,醋酸浓度最大;
(2)等浓度时,硫酸生成CO2体积最大;
(3)物质的量浓度相等时,硫酸溶液中c(H+)最大,醋酸最小,与碱反应时,硫酸消耗氢氧化钠最多;
Ⅱ.先将物质的按照碱、盐、酸的顺序分类,再根据盐的水解和弱电解质的电离特点比较PH,再按照溶液的PH由大到小进行排序.
(5)硫酸抑制水的电离,pH=5的硫酸,c(H+)=10-5mol/L,pH=3的盐酸溶液中c(H+)=10-3mol/L,溶液中OH-全部由水电离产生,水电离出的c(H+)=c(OH-),以此解答.
解答 解:Ⅰ.(1)在同体积、同pH的三种酸中,醋酸和NaHCO3反应时能产生氢离子的物质的量最大,所以加入足量的NaHCO3,在相同条件下产生CO2的体积最大,盐酸和硫酸都是强酸,同体积、同pH的两种酸中氢离子的物质的量是一样的,产生的CO2是一样的,
故答案为:c>b=a;
(2)在同体积、同浓度的三种酸中,盐酸、醋酸、硫酸的物质的量是相等的,分别加入足量的NaHCO3粉末,在相同条件下盐酸和醋酸产生CO2的体积一样,但是硫酸是二元酸,加入足量的NaHCO3粉末,在相同条件下产生CO2的体积是盐酸、醋酸的2倍,所以产生CO2的体积由大到小的顺序是b>a=c,
故答案为:b>a=c;
(3)硫酸是二元强酸,0.1mol•L-1的硫酸中氢离子浓度是0.2mol•L-1,盐酸是一元强酸,0.1mol•L-1的硫酸中氢离子浓度是0.2mol•L-1,醋酸是一元弱酸,
0.1mol•L-1的硫酸中氢离子浓度小于0.1mol•L-1,氢离子浓度越大,则pH越小,所以三种酸溶液的pH由大到小的顺序是c>a>b,
等体积的0.1mol•L-1的三种酸溶液,硫酸是二元酸,消耗的氢氧化钠最多,醋酸和盐酸都是一元酸,物质的量一样,消耗氢氧化钠一样多,所以用0.1mol•L-1的NaOH溶液中和,消耗NaOH溶液的体积由大到小的顺序是b>c=a,
故答案为:c>a>b;b>c=a;
Ⅱ.属于碱的为:④Ba(OH)2⑤NaOH,⑨NH3.H2O浓度相同时,碱性④>⑤>⑨;
水解呈碱性的为:⑥CH3COONa,⑩NaHCO3但水解程度较小,乙酸的酸性强于碳酸,则pH:④>⑤>⑨>⑩>⑥;
溶液呈中性的为:⑦KCl;
溶液呈酸性的有:①②③⑧,其中①为一元强酸,②为二元强酸,③为弱酸,⑧水解呈酸性,浓度相同时,
溶液的pH:②<①<③<⑧,
综合以上分析可知,溶液的PH由小到大的顺序为:②<①<③<⑧<⑦<⑥<⑩<⑨<⑤<④,
故答案为:②<①<③<⑧<⑦<⑥<⑩<⑨<⑤<④;
(5)水的电离方程式为:H2O?H++OH-,25℃时kw=c(H+)×c(OH-)═1×10-14,pH=5的硫酸,c(H+)=10-5mol/L,由水电离生成的c(H+)=c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-5}}$mol/L=10-9mol/L,pH=3的盐酸,c(H+)=10-3mol/L,由水电离生成的c(H+)=c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-3}}$mol/L=10-11mol/L,
因此由水电离出的c(H+)之比为:10-9mol/L:10-11mol/L=100,
故答案为:100.
点评 本题考查学生弱酸和强酸的电离以及酸碱中和反应知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意知识的归纳和整理是解题关键,难度不大.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | X 的最高价氧化物对应的水化物酸性最强 | |
| B. | 化合物XY2、ZY2均能溶于水生成含氧酸 | |
| C. | Y的氢化物比W的氢化物沸点高 | |
| D. | 四种元素中W原子半径最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
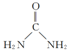 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

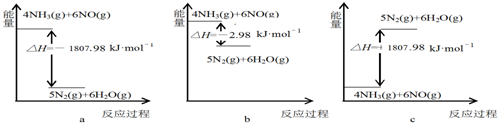
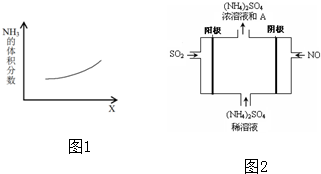
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | a电极的反应为:3CO2+18H+-18e-═C3H8O+5H2O | |
| C. | 每生成1 mol O2,有44 g CO2被还原 | |
| D. | 该装置工作时H+从b极区向a极区迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
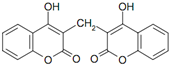
| A. | 分子式为C19H10O6 | |
| B. | 遇FeCl3溶液能发生显色反应 | |
| C. | 1 mol双羟香豆素最多能与含 4 mol氢氧化钠的水溶液完全反应 | |
| D. | 1 mol双羟香豆素最多能与 10 mol氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com