
| A. | Na+的轨道表示式: | B. | Na+的结构示意图: | ||
| C. | Na的电子排布式:1s22s22p63s1 | D. | Na的简化电子排布式:[Ne]3s1 |
分析 钠原子的电子排布式为1s22s22p63s1,或写为[Ne]3s1,Na+的原子核内有11个质子,核外有10个电子,Na为金属元素,易失去电子,所以其价电子排布式为:3s1,轨道表示式用箭头“↑”或“↓”来区别自旋方向的不同电子,每个轨道最多容纳2个电子且自旋方向相反,据此分析解答.
解答 解:A.轨道表示式用一个方框或圆圈表示能级中的轨道,用箭头“↑”或“↓”来区别自旋方向的不同电子,每个轨道最多容纳2个电子,2个电子处于同一轨道内,且自旋方向相反,所以Na+的轨道表示式: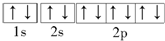 ,故A错误;
,故A错误;
B.Na+的原子核内有11个质子,核外有10个电子,结构示意图为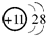 ,故B正确;
,故B正确;
C.钠原子的电子排布式为1s22s22p63s1,或写为[Ne]3s1,故C正确;
D.钠原子的简化电子排布式为[Ne]3s1,故D正确;
故选A.
点评 本题考查原子核外电子排布,为高考常见题型,难度不大,注意把握原子核外电子的排布规律,把握电子排布式和轨道式的书写方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
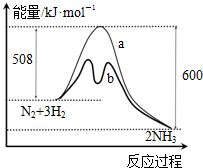
| A. | 升高温度可增大正反应速率,降低逆反应速率 | |
| B. | 正反应的活化能大于逆反应的活化能 | |
| C. | a曲线是未加入催化剂时的能量变化曲线 | |
| D. | 该反应的热化学方程式为:2NH3?N2+3H2△H=-92 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓的氢氟酸溶液中存在HF${\;}_{2}^{-}$和H2F${\;}_{3}^{-}$ | |
| B. | SiH4沸点比CH4高 | |
| C. | 水和乙醇分别与金属钠反应,前者比后者剧烈 | |
| D. | H2O比H2S稳定,前者1000℃以上才分解,后者300℃分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜作阳极,镀件作阴极,溶液中含有铜离子 | |
| B. | 铁作阴极,镀件作阳极,溶液中含有铜离子 | |
| C. | 铁作阳极,镀件作阴极,溶液中含有亚铁离子 | |
| D. | 铜用阴极,镀件作阳极,溶液中含有锌离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com