
 ������������Դ���������й㷺��;��������Ni���������缫���ŨNaOH��Һ�Ʊ��������ƣ�Na2FeO4����װ����ͼ��ʾ������˵����ȷ���ǣ�������
������������Դ���������й㷺��;��������Ni���������缫���ŨNaOH��Һ�Ʊ��������ƣ�Na2FeO4����װ����ͼ��ʾ������˵����ȷ���ǣ�������| A�������������缫��ӦΪFe-2e-+2OH-�TFe��OH��2 |
| B�����һ��ʱ������缫������Һ��pH��С |
| C�������ӽ���ĤΪ�����ӽ���Ĥ����������������Һ�к���FeO42- |
| D��ÿ�Ƶ�1mol Na2FeO4�������Ͽ��Բ���67.2L���� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ѡ�� | ������ | ���ۼ����ӷ���ʽ | |
| A | |
H+��Fe2+��NO3-��Cl- | ���ܴ���������ͬһ��Һ�У���Ϊ������Ӧ��Fe2++2H+=Fe3++H2�� |
| B | |
Na+��K+��HCO3-��OH- | ���ܴ���������ͬһ��Һ�У���Ϊ������Ӧ�� HCO3-+OH-=H2O+CO2�� |
| C | |
Ca2+��NH4+��CO32-��Cl- | �ܴ���������ͬһ��Һ�� |
| D | |
Na+��NH4+��SO42-��Cl- | �ܴ���������ͬһ��Һ�� |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
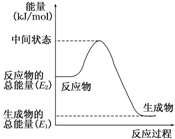 �״������ǿ��������õ�һ������Դ��
�״������ǿ��������õ�һ������Դ��| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��SO2��SO3��Ϊͬ���칹�� |
| B��Һ�����������ͬ�������� |
| C�����ʯ��ʯī������̼ԭ�ӹ��ɣ����������ͬ������ |
| D���Ҵ��Ͷ����ѻ�Ϊͬ���칹�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1 mol NH4+ ����������Ϊ10NA |
| B��10����������ԭ����ԼΪNA |
| C��1mol����������������Һ��ȫ���գ�ת�Ƶĵ�����ΪNA |
| D����״���£�44.8L�嵥�������ķ�����Ϊ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ʹ�⻯�ص�����ֽ��������Һ��Na+��NH4+��S2-��Br- |
| B����pH��ֽ���ɫ����Һ��Fe2+��S2O32-��SO42-��Na+ |
| C��ˮ�������c��H+��?c��OH-��=10-28����Һ��Na+��S2-��NO3-��SO32- |
| D����ʹKSCN�Ժ�ɫ����Һ��Na+��NH4+��AlO2-��CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���õ�ȼ�Ļ����Һ������ƿ�ڼ����Ƿ�©�� |
| B����ˮ����Ũ������������ϡ���� |
| C����������ʵ��Ӧ�Ӽ�����ʯ�������Ƭ�� |
| D���ơ�������Ļ��ֿ�����ĭ�������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com