

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.9 | 8.9 |
| Fe2+ | 5.8 | 8.8 |
分析 炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)加盐酸溶解,形成氯化锌、氯化铜、氯化亚铁的溶液,加锌粉置换出Cu,过滤,滤液中含有锌离子和亚铁离子,加过氧化氢氧化,把亚铁离子氧化为铁离子,加ZnO(或氢氧化锌等)调节PH,铁离子转化为氢氧化铁沉淀,过滤除去沉淀,得到氯化锌溶液.
(1)水解为吸热反应,根据温度高促进金属离子水解,以及双氧水受热易分解来回答;
(2)加锌粉置换出Cu,过滤沉淀A为铜;
(3)调节pH时要消耗氢离子,调节pH使铁离子转化为沉淀,而锌离子不沉淀,根据表中数据分析,Zn2(OH)2CO3,与氢离子反应生成锌离子、二氧化碳和水.
解答 解:(1)“酸溶”后,形成氯化锌、氯化铜、氯化亚铁的溶液,温度过高,促进离子水解,易形成沉淀,后续需加过氧化氢亚铁离子氧化为铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,温度过高会导致双氧水分解,
故答案为:防止金属离子水解形成沉淀,以及温度过高H2O2发生分解;
(2)炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)加盐酸溶解,形成氯化锌、氯化铜、氯化亚铁的溶液,加锌粉置换出Cu,过滤,滤液中含有锌离子和亚铁离子,过滤沉淀A为铜,
故答案为:Cu;
(3)调节pH时要消耗氢离子,但是不能引入杂质,调节pH使铁离子转化为沉淀,而锌离子不沉淀,由表中数据可知pH≥3.2时,铁离子完全沉淀,而锌离子开始沉淀的pH为5.9,所以要调节pH为3.2≤pH<5.9,Zn2(OH)2CO3与酸反应,Zn2(OH)2CO3+4H+=2Zn2++3H2O+CO2↑,
故答案为:3.2≤pH<5.2;Zn2(OH)2CO3+4H+=2Zn2++3H2O+CO2↑.
点评 本题考查了物质的制备工艺流程,侧重于流程的分析、物质的分离提纯的应用等知识点的考查,题目难度中等,考查了学生对基础知识的综合应用能力.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:解答题
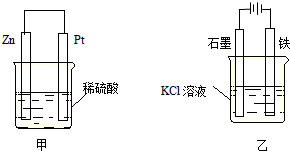
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
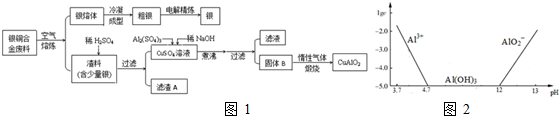
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
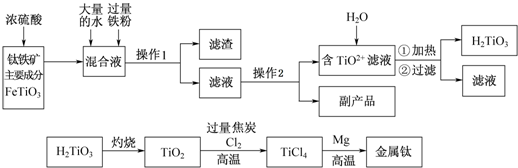
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
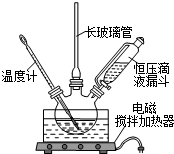 硝基苯是医药和染料的中间体,还可做有机溶剂.反应如下:
硝基苯是医药和染料的中间体,还可做有机溶剂.反应如下:
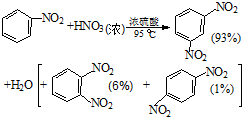
| 物质 | 熔点/ ℃ | 沸点 /℃ | 密度(20℃) /g•cm-3 | 水溶性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

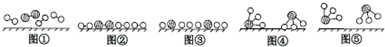
 、
、 、
、 分别表示N2、H2、NH3图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别 是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂
分别表示N2、H2、NH3图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别 是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂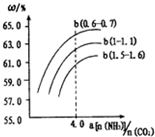
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
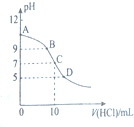 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mLamol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mLamol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )| A. | A点溶液中加少量水,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$减小 | |
| B. | 原氨水的物质的量浓度约为1.006×10-2mol•L-1 | |
| C. | B、D两点溶液中水电离出来的c(OH-):B<0 | |
| D. | C点溶液中的H2O不发生电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.001mol•L-1•s-1 | B. | v(NO)=0.0015 mol•L-1•s-1 | ||
| C. | v(H20)=0.003 mol•L-1•s-1 | D. | v(NH3)=0.001 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | I在DB2中燃烧生成两种化合物 | |
| B. | A、H、J的离子半径由大到小顺序是H>J>A | |
| C. | HE3中H与E之间以离子键结合 | |
| D. | A单质能从B的氢化物中置换出B单质来 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com