
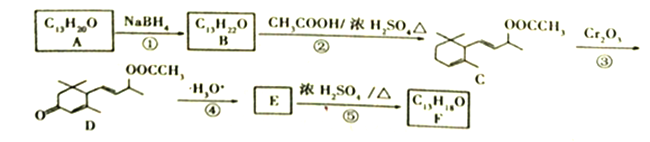
【题目】【题目】工业合成有机物F的路线如下:
已知:①![]() ;
;
②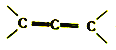 结构不稳定,不子考虑。
结构不稳定,不子考虑。
(1)A中含氧官能团的名称为_______________;C→D反应③的类型为_____________。
(2)化合物B的结构简式为__________;F与Br2按物质的量之比1:1加成所得产物有____种。
(3)E→F的化学方程式为___________________________。
(4)上述转化关系中,设计步骤②和④的目的是______________________________________。
(5)H是A的同分异构体,任写一种满足以下条件的H的结构简式________________。
①与FeCl3溶液发生显色反应。
②核磁共振氢谱有5组峰,且峰面积之比为1:2:2:3:12。
(6)参照上述合成路线,设计并写出用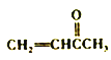 合成聚1.3-丁二烯的路线流程图(无机试剂任选)。 ______________________________
合成聚1.3-丁二烯的路线流程图(无机试剂任选)。 ______________________________
【答案】 羰基 氧化反应 ![]() 4
4  保护羟基防止被CrO3氧化
保护羟基防止被CrO3氧化 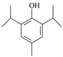 或
或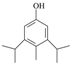
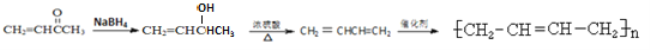
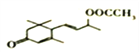
【解析】试题分析:B生成C属于酯化反应,根据C的结构简式,逆推B是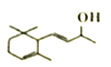 ,A发生还原反应生成B,则A是
,A发生还原反应生成B,则A是![]() ;
; 发生水解反应生成E,则E是
发生水解反应生成E,则E是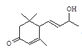 ;
; 在浓硫酸作用下发生氧化反应消去反应生成F,则F是
在浓硫酸作用下发生氧化反应消去反应生成F,则F是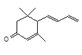 ;
;
解析:根据以上分析,(1)A是![]() ,含氧官能团的名称为羰基;
,含氧官能团的名称为羰基;![]() →
→ 分子中加入了氧原子,去掉了氢原子,所以反应③的类型为氧化反应。(2)化合物B的结构简式为
分子中加入了氧原子,去掉了氢原子,所以反应③的类型为氧化反应。(2)化合物B的结构简式为![]() ;
; 与Br2按物质的量之比1:1加成所得产物有
与Br2按物质的量之比1:1加成所得产物有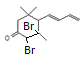 、
、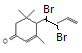 、
、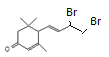 、
、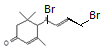 共4种。(3)
共4种。(3) 在浓硫酸作用下发生氧化反应消去反应生成
在浓硫酸作用下发生氧化反应消去反应生成 的化学方程式为
的化学方程式为 。(4)羟基易被氧化,上述转化关系中,设计步骤②和④的目的是保护羟基防止被CrO3氧化。(5)①与FeCl3溶液发生显色反应,说明不含上含有羟基;②核磁共振氢谱有5组峰,且峰面积之比为1:2:2:3:12,结构对称;符合条件的A的同分异构体是
。(4)羟基易被氧化,上述转化关系中,设计步骤②和④的目的是保护羟基防止被CrO3氧化。(5)①与FeCl3溶液发生显色反应,说明不含上含有羟基;②核磁共振氢谱有5组峰,且峰面积之比为1:2:2:3:12,结构对称;符合条件的A的同分异构体是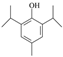 或
或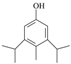 。(6)
。(6)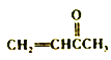 先还原为
先还原为![]() ,
,![]() 在浓硫酸作用下发生氧化反应消去反应生成
在浓硫酸作用下发生氧化反应消去反应生成![]() ,
,![]() 发生加聚反应生成聚1.3-丁二烯,合成路线是
发生加聚反应生成聚1.3-丁二烯,合成路线是![]() 。
。


科目:高中化学 来源: 题型:
【题目】对于恒定容积的密闭容器中进行的反应A(s)+B(g)![]() 2C(g) ΔH<0,平衡后只改变下列条件,有关叙述正确的是
2C(g) ΔH<0,平衡后只改变下列条件,有关叙述正确的是
A. 加入少量A物质,平衡正向移动,正反应速率加快
B. 加入少量B物质,平衡正向移动,逆反应速率减小
C. 充入氩气(不参加反应),平衡逆向移动,逆反应速率加快
D. 升高温度,平衡逆向移动,正反应速率和逆反应速率都加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中能大量共存的一组离子是( )
A.NH4+、Ba2+、Brˉ、CO32ˉ
B.Clˉ、NO3ˉ、Fe2+、H+
C.K+、Na+、SO42ˉ、MnO4ˉ
D.Na+、H+、SO42ˉ、HCO3ˉ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素在周期表中的位置是_____________,其基态原子的电子排布式为[Ar]_______。
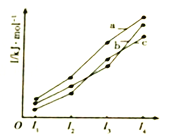
(2)如图表示X、Y、Z的四级电离能变化趋势,其中表示Z的曲线是_______(填标号)。
(3)化合物(XH2=X=O)分子中X原子杂化轨道类型是____________,1mol(X2H5O)3Z=O分子中含有的σ键与π键的数目比为__________________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为_____。
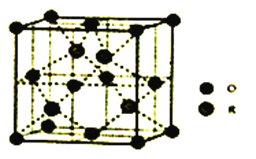
(5)某R的氧化物晶胞结构如图所示。该物质的化学式为_______________。已知该晶体密度为pg·cm-3,距离最近的两个原子的距离为dpm,则R的相对原子质量计算表达式为___________________________(已知lpm=10-12m,阿伏加德罗常数为NA)。
(6)X形成的一种常见单质,性质硬而脆,原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬与铁具有相似的化学性质。醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O(摩尔质量376g/mol)是一种氧气吸收剂,红棕色晶体,易被氧化;易溶于盐酸,微溶于乙醇,难溶于水和乙醚。其制备装置(已省略加热及支持装置)和步骤如下:
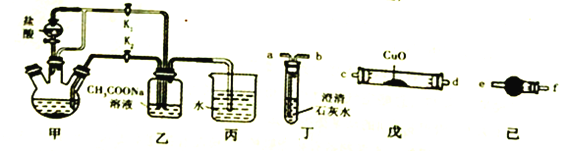
I.组装实验仪器后,首先进行必要的操作A。
II.往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液,再往其它仪器中加入相应的药品。
III.关闭K2,打开K1,旋开分液漏斗的旋塞并控制好滴速。
IV.待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液自动转移到装置乙中,当出现大量红棕色晶体时,关闭分液漏斗旋塞。
V.将装置乙中混合物快速过滤、洗涤和干燥,称量。
回答下列问题:
(1)步骤I中“操作A”为_____________;装置丙中导管口水封的目的主要是_________________________________。
(2)三颈烧瓶中的锌除与盐酸反应外,另发生的一个反应的化学方程式为_______________。
(3)步骤IV中溶液自动转移至装置乙中的实验操作为_______________;生成红棕色晶体的离子反应方程式____________________________。
(4)为得到纯净干燥的产品,洗涤时按使用的先后顺序选用下列洗涤剂__________(填序号)。
①乙醚②蒸馏水(煮沸冷却) ③无水乙醇 ④盐酸
(5)一定条件下[Cr(CH3COO)2]2·2H2O受热反应得到的气态产物含CO、CO2。请从丁、戊、己装置中选取必要装置检验这两种气体(不考虑尾气处理):
气态产物→_______________________→a(填接口字母序号)。
(6已知实验所用到的试剂中,CrCl3溶液中含溶质19.02g,0.1mol/L醋酸钠溶液为1.6L,其它反应物足量。实验后得到纯净干燥的[Cr(CH3COO)2]2·2H2O晶体11.28g,则该实验所得产品的产率为________(结果保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,22.4LHCl气体溶于50mL水再配成250mL溶液:
(1)求所得盐酸的物质的量浓度_____
(2)若将此溶液再稀释成1L溶液,求稀释后盐酸的物质的量浓度_____
(3)将(2)的溶液取出500mL与足量的Zn反应可以产生多少体积的H2(在标准状况下)_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2) 作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。某研究小组设计如图所示装置制备ClO2和NaClO2。已知: ClO2熔点一59℃、沸点11℃,常温下ClO2为黄绿色或橘黄色气体,ClO2浓度过高或受热易分解,甚至会爆炸。NaClO2 高于60℃时分解生成NaClO3和NaCl。

(1)装置连接好后,加入药品前需进行的操作是____________________________________。
(2)使用恒压分液漏斗的目的是_________________;仪器B 的作用是_________________。
(3)A 中反应为2NaClO3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O。
C 中反应的化学方程式是_______________, 冷水浴的目的是_________________________。
(4) 实验中持续通入空气能稀释生成的ClO2并将其排到C处。若空气的流速太慢可能造成的后果是_______________________________________。
(5)已知: ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH 的关系如图所示。当pH≤2.0 时,ClO2-也能被I- 完全还原为Cl-。反应生成的I2与Na2S2O3 反应的方程式: 2Na2S2O3+ I2= Na2S4O6 + 2NaI。
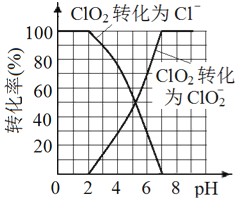
用ClO2消毒的饮用水中含有ClO2、ClO2-。测定饮用水中ClO2、ClO2-的含量,分两步进行:
①用紫外分光光度法测得水样中ClO2的含量为amol/L。
②用滴定法测量ClO2-的含量。请完成相应的实验步骤:
步骤1: 准确量取VmL 上述水样加入锥形瓶中。
步骤2: 调节水样的pH________。
步骤3: 加入足量的KI 晶体,充分反应。
步骤4: 加入少量淀粉溶液,用cmol/L Na2S2O3 溶液滴定至终点,消耗Na2S2O3 溶液V1mL。
根据上述分析数据,测得该饮用水中ClO2-的浓度为____mol/L( 用含字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com