
 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.分析 A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素,A原子在基态时p轨道半充满且电负性是同族元素中最大的,则A为第VA族元素,同一主族元素中,元素的电负性随着原子序数的增大而减小,所以A为N元素;
D、E原子核外的M层中均有两个未成对电子,E的原子序数大于D,所以D为Si元素、E为S元素;
B、E两元素组成化合物B2E的晶体为离子晶体,说明B为活泼金属,B的原子序数大于A,所以B为Na元素;
C、F的原子均有三个能层,为第三周期元素,E的原子序数小于F,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575,则E为Al元素,C为Mg元素;
G原子核外最外层电子数与B相同,G最外层电子数是1,其余各层均充满,则G元素的核电荷数=2+8+18+1=29,为Cu元素;
F位于第三周期且能和C形成化合物,则F为Cl元素,C与F能形成原子数目比为1:3、熔点为190℃的化合物Q,结合物质的结构来分析解答.
解答 解:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素,A原子在基态时p轨道半充满且电负性是同族元素中最大的,则A为第VA族元素,同一主族元素中,元素的电负性随着原子序数的增大而减小,所以A为N元素;
D、E原子核外的M层中均有两个未成对电子,E的原子序数大于D,所以D为Si元素、E为S元素;
B、E两元素组成化合物B2E的晶体为离子晶体,说明B为活泼金属,B的原子序数大于A,所以B为Na元素;
C、F的原子均有三个能层,为第三周期元素,E的原子序数小于F,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575,则E为Al元素,C为Mg元素;
G原子核外最外层电子数与B相同,G最外层电子数是1,其余各层均充满,则G元素的核电荷数=2+8+18+1=29,为Cu元素;
F位于第三周期且能和C形成化合物,则F为Cl元素,C与F能形成原子数目比为1:3、熔点为190℃的化合物Q,
(1)Na的单质晶体为体心立方堆积模型,8个顶点上各有一个原子,体心上含有一个原子,所以其配位数为8;
E元素的最高价氧化物为SO3,三氧化硫分子中价层电子对个数是3且不含孤电子对,所以三氧化硫分子的立体构型是平面三角形;
F是Cl元素,原子核外有17个电子,根据构造原理知,F元素原子的核外电子排布式是1s22s22p63s23p5;
G的高价离子与A的简单氢化物形成的配离子为铜氨络离子,铜氨络离子的化学式为[Cu(NH3)4]2+,
故答案为:8;平面三角形;1s22s22p63s23p5;[Cu(NH3)4]2+;
(2)B和E形成的化合物是氯化钠,D和E形成的化合物是四氯化硅,氯化钠为离子晶体,四氯化硅为分子晶体,一般来说,离子晶体的熔点大于分子晶体,所以氯化钠的熔点高于四氯化硅,
故答案为:NaCl的熔点高于SiCl4,因为NaCl是离子晶体,SiCl4是分子晶体;
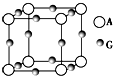
(3)A为N元素,G为Cu元素,该晶胞中,Cu原子个数=12×$\frac{1}{4}$=3,N原子个数=8×$\frac{1}{8}$=1,该晶胞的化学式为
Cu3N,该晶胞的边长=$\root{3}{\frac{m}{ρ}}$=$\root{3}{\frac{\frac{206}{{N}_{A}}}{a}}$cm=$\root{3}{\frac{206}{a{N}_{A}}}$cm,
故答案为:$\root{3}{\frac{206}{a{N}_{A}}}$;
(4)在1.0l×105 Pa、t1℃时,气体摩尔体积为53.4L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的组成为(写化学式).
(4)$ρ=\frac{M}{{V}_{m}}$,所以M=ρVm=5.00g/L×53.4L/mol=267g/mol,AlCl3的摩尔质量为133.5g/mol,Q的摩尔质量是氯化铝的2倍,所以Q分子中含有2个铝原子和6个氯原子,其化学式为Al2Cl6,
故答案为:Al2Cl6.
点评 本题考查了元素位置结构性质的相互关系及应用,涉及晶胞的计算、化学式的确定、原子核外电子排布式的书写等知识点,正确推断元素是解本题关键,再结合题给信息进行分析解答,难点的晶胞的计算,根据密度公式解答即可,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
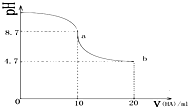
| A. | a点所示溶液中有c(Na+)>c(A-)>c(HA)>c(H+) | |
| B. | a、b两点曲线之间某时刻的溶液中有c(Na+)=c(A-) | |
| C. | a、b两点所示溶液中水的电离程度相同 | |
| D. | b点所示溶液中有 2c(Na+)=c(A-)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在HCl、MgCl2和AlCl3的混合溶液中,滴加NaOH溶液至过量,如图
在HCl、MgCl2和AlCl3的混合溶液中,滴加NaOH溶液至过量,如图查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com