
| A. | NaCl晶体中阴、阳离子 | B. | NH3分子中的质子和电子 | ||
| C. | Na2O2固体中阴、阳离子 | D. | ${\;}_{1}^{2}$H原子中的质子和中子 |
分析 A、阳离子为Na+、阴离子为Cl-;
B、质子数为10,中子数10;
C、阳离子为Na+阴离子为O2 2-;
D、该原子中质子数、中子数分别是1.
解答 解:A、因阳离子为Na+、阴离子为Cl-,所以阴离子和阳离子之比为1:1;故A不选;
B、NH3分子中质子数为10,电子数10,所以质子数和电子数之比为1:1;故B不选;
C、Na2O2固体中阳离子为Na+,阴离子为O2 2-,所以阴离子和阳离子之比为1:2,故C选;
D、2H原子中的质子和中子分别是1,所以质子数和中子数之比是1:1,故D不选;
故选:C.
点评 本题考查了原子结构、离子化合物的构成,题目难度不大,侧重于基础知识的考查.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | NaH在水中显酸性 | B. | NaH中氢离子电子层排布与氦相同 | ||
| C. | NaH中氢离子半径比锂离子半径小 | D. | NaH中氢离子被还原为H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
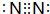 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | NH4+、K+、Al3+、Mg2+ |
| 阴离子 | HCO3-、Cl-、MnO4-、SO42- |
| A. | 肯定没有Mg2+、HCO3-、Cl-、MnO4- | |
| B. | 一定含有K+,且c(K+)=2mol/L | |
| C. | 该溶液可能是KAl(SO4)2和NH4Al(SO4)2的混合溶液 | |
| D. | 若仅根据实验③,将该溶液蒸干、灼烧,有可能得到仅含有氧化铝固体物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素的原子最外层电子数都大于或等于4 | |
| B. | 只有非金属能形成含氧酸或含氧酸盐 | |
| C. | Na2O2中阴阳离子的个数比为1:1 | |
| D. | 非金属元素组成的化合物不一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

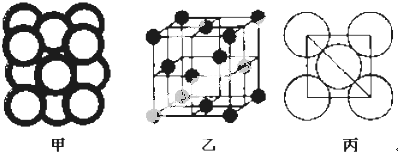
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加体系的压强 | B. | 减少C的物质的量浓度 | ||
| C. | 增加A的物质的量 | D. | 升高体系的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com