

【题目】X、Y、Z、W 四种物质有如下相互转化关系(其中 Y、Z 为化合物,未列出反应条件)。

(1)若实验室经常用澄清石灰水来检验 X 的燃烧产物,W 的用途之一是计算机芯片,W 在周期表中的位置为 ___________,Y 的用途有 _________,写出Y与NaOH 溶液反应的离子方程式 _________。
(2)若 X、W 为日常生活中常见的两种金属,且 Y 常用作红色油漆和涂料,则该反应的化学方程式为___________。
(3)若 X 为淡黄色粉末,Y 为生活中常见液体,则:
①X 的电子式为 _______________,该反应的化学方程式为 ____________,生成的化合物中所含化学键类型有 ________________________。
② 若 7.8 克 X 物质完全反应,转移的电子数为 ___________。
【答案】第三周期 ⅣA族 光导纤维 SiO2+2OH-=SiO32-+H2O ![]()
![]() 2Na2O2+2H2O=4NaOH+O2↑ 离子键、极性键 0.1NA
2Na2O2+2H2O=4NaOH+O2↑ 离子键、极性键 0.1NA
【解析】
⑴若实验室经常用澄清石灰水来检验 X 的燃烧产物,即X为碳,W 的用途之一是计算机芯片,即为硅,W 在周期表中的位置为第三周期第IVA族,Y为二氧化硅,它的用途有 光导纤维,写出Y与NaOH 溶液反应的离子方程式SiO2+2OH-=SiO32-+H2O,
故答案为第三周期ⅣA族;光导纤维;SiO2+2OH-=SiO32-+H2O;
⑵若X、W为日常生活中常见的两种金属,且Y常用作红色油漆和涂料即为氧化铁,两者发生铝热反应,则该反应的化学方程式为2Al + Fe2O3 ![]() 2Fe+ Al2O3,
2Fe+ Al2O3,
故答案为2Al + Fe2O3 ![]() 2Fe+ Al2O3;
2Fe+ Al2O3;
⑶若X为淡黄色粉末即为过氧化钠,Y 为生活中常见液体即为 ,则:
①X的电子式为![]() ,该反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,生成的化合物NaOH所含化学键类型有离子键、极性键,
,该反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,生成的化合物NaOH所含化学键类型有离子键、极性键,
故答案为![]() ;2Na2O2+2H2O=4NaOH+O2↑;离子键、极性键;
;2Na2O2+2H2O=4NaOH+O2↑;离子键、极性键;
②过氧化钠中一个氧升高一价,一个氧降低一价,若7.8克过氧化钠即0.1 mol完全反应,转移的电子数为0.1NA,
故答案为0.1NA。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.H2(g)+I2(g)2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
B.C(s)+H2O(g)H2(g)+CO(g),碳的质量不再改变说明反应已达平衡
C.若压强不再随时间变化能说明反应2A(?)+B(g)2C(?)已达平衡,则A、C不能同时是气体
D.1 mol N2和3 mol H2反应达到平衡时H2转化率为10%,放出的热量为Q1;在相同温度和压强下,当2 mol NH3分解为N2和H2的转化率为10%时,吸收的热量为Q2,Q2不等于Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叶酸可以由下列甲、乙、丙三种物质合成。
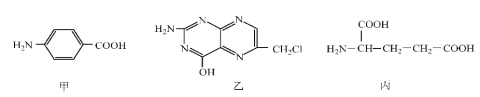
(1)甲的最简式为_____;丙中含有官能团的名称为____。
(2)下列关于乙的说法正确的是______(填序号)。
a.分子中碳原子与氮原子的个数比是7:5 b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应 d.属于苯酚的同系物
(3)甲在一定条件下能单独聚合成高分子化合物,请写出该反应的化学方程式:____。
(4)甲可以通过下列路线合成(分离方法和其他产物已经略去):
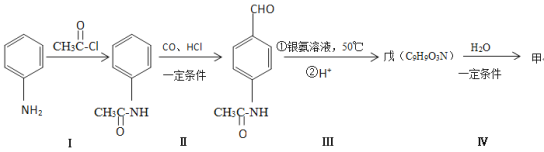
①步骤Ⅰ的反应类型是_______。
②步骤I和IV在合成甲过程中的目的是______。
③步骤IV反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品。某研究小组制备硫代硫酸钠晶体(Na2S2O3·5H2O)的实验装置如图所示(省略夹持装置):
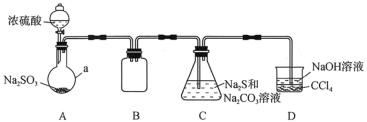
(查阅资料)
Ⅰ.Na2S2O3·5H2O是无色晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;
Ⅱ.向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3。
根据题意,填写下列空白。
(1)仪器a的名称是___;B的作用是___。
(2)C中反应氧化剂与还原剂的物质的量之比为___。
(3)该实验制取的产品中常含有少量Na2SO3和Na2SO4杂质。为了检验产品中是否含有这两种杂质,某小组设计了以下实验方案(所需试剂从稀硝酸、稀硫酸、稀盐酸、蒸馏水中选择),请将方案补充完整。
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤、洗涤后,向沉淀中滴加足量的___(填试剂名称),若___(填实验现象),则可以确定产品中含有Na2SO3和Na2SO4。
(4)称取样品137.5g配成500mL溶液。取50mL溶液,向其中加入足量稀硫酸,充分反应(S2O![]() +2H+=S↓+SO2↑+H2O),静置、过滤、洗涤、干燥、称量得沉淀1.6g。
+2H+=S↓+SO2↑+H2O),静置、过滤、洗涤、干燥、称量得沉淀1.6g。
准确配制500mL溶液所需仪器有:天平、药匙、烧杯、玻璃棒、___、___。经计算,样品中硫代硫酸晶体的百分含量为___。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝合金溶于 100 mL 稀硝酸中,产生 1.12 L NO气体(标准状况),向反应后的溶液中加入 NaOH 溶液,产生沉淀情况如图所示。下列说法不正确的是

A.可以求出合金中镁铝的物质的量比为 1∶1B.可以求出硝酸的物质的量浓度
C.可以求出沉淀的最大质量为 3.21 克D.氢氧化钠溶液浓度为 3 mol / L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用固体KOH配制0.1 mol/L的KOH溶液 480 mL,回答下列问题:
(1)配制过程中需要用到的玻璃仪器有______。
(2)需要用托盘天平称量______g KOH固体。
(3)如果在定容时仰视操作,则所配得溶液的浓度______0.1 mol/L(填>,=,<)。
(4)若所用的固体KOH中混有NaOH,则所配得溶液的c(OH-)浓度______0.1 mol/L (填>,=,<)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应mA(s) + nB(g) ![]() eC(g) + f D(g),当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
eC(g) + f D(g),当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
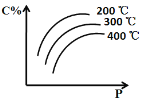
A. 化学方程式中n<e +f
B. 达到平衡后,若升温,v正减小,v逆增大
C. 达到平衡后,增加B的量,B的转化率增大
D. 若B为有色物质,达到平衡后缩小容器体积,重新达平衡后与原平衡比较气体颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为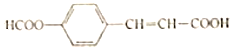 有关该化合物的叙述不正确的是( )
有关该化合物的叙述不正确的是( )
A.所有碳原子可能共平面
B.可以发生水解、加成和酯化反应
C.1mol该物质最多消耗2molNaOH
D.苯环上的二溴代物同分异构体数目为4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com