
 ��֪��pKa=-lgKa��25��ʱ��H2A��pKa1=1.85��pKa2=7.19����0.1mol•L-1 NaOH��Һ�ζ�20mL0.1mol•L-1H2A��Һ�ĵζ�������ͼ��ʾ�������ϵ�����ΪpH��������˵������ȷ���ǣ�������
��֪��pKa=-lgKa��25��ʱ��H2A��pKa1=1.85��pKa2=7.19����0.1mol•L-1 NaOH��Һ�ζ�20mL0.1mol•L-1H2A��Һ�ĵζ�������ͼ��ʾ�������ϵ�����ΪpH��������˵������ȷ���ǣ�������| A�� | a��������Һ�У�2n��H2A��+n��A2-��=0.002mol | |
| B�� | b��������Һ�У�c��H2A��+c��H+��=c��A2-��+e��OH-�� | |
| C�� | C��������Һ�У�c��Na+����3c��HA-�� | |
| D�� | d��������Һ�У�c��Na+����c��A2-����c��HA-�� |
���� A����0.1mol•L-1NaOH��Һ�ζ�20mL0.1mol•L-1H2A��Һ��a����Һ������ΪH2A��NaHA��PH=1.85=Pa1����c��H2A��=c��HA-�����������غ��жϣ�
B�������ʵ���ǡ�÷�Ӧ����NaHA����Һ�����ԣ�������Һ�е���غ�������غ��������жϣ�
C��c��PH=7.19��Һ�Լ��ԣ�c��OH-����c��H+����c��H+��=10-7.19mol/L��Ka2=$\frac{c��{A}^{2-}����c��{H}^{+}��}{c��H{A}^{-}��}$=10-7.19������c��HA-��=c��A2-���������Һ�е���غ������
D����������������Һ40ml��NaOH��Һ�ζ�20mL0.1mol•L-1HA��Һǡ�÷�Ӧ����Na2A��d����Һ����Ҫ��Na2A������NaHA��
��� �⣺A����0.1mol•L-1NaOH��Һ�ζ�20mL0.1mol•L-1H2A��Һ��a����Һ������ΪH2A��NaHA��PH=1.85=Pa1����c��H2A��=c��HA-������Һ�������20ml��a��������Һ�У�n��H2A��+n��A2-��+n��HA-��=2n��H2A��+n��A2-��=0.002mol����A��ȷ��
B��b������0.1mol•L-1NaOH��Һ20ml�ζ�20mL0.1mol•L-1H2A��Һ��ǡ�÷�Ӧ����NaHA����Һ�����ԣ���Һ�е���غ�c��Na+��+c��H+��=c��HA-��+c��OH-��+2c��A2-���������غ�c��Na+��=c��HA-��+c��A2-��+c��H2A�����õ���c��H2A��+c��H+��=c��A2-��+c��OH-������B��ȷ��
C��c��PH=7.19��Һ�Լ��ԣ�c��OH-����c��H+����c��H+��=10-7.19mol/L��Ka2=$\frac{c��{A}^{2-}����c��{H}^{+}��}{c��H{A}^{-}��}$=10-7.19������c��HA-��=c��A2-������Һ�е���غ�Ϊ��c��Na+��+c��H+��=c��HA-��+c��OH-��+2c��A2-����
��֪��HA-��=c��A2-������c��Na+��+c��H+��=3c��HA-��+c��OH-����
����c��OH-����c��H+��������c��Na+����3c��HA-������C����
D����������������Һ40ml��NaOH��Һ�ζ�20mL0.1mol•L-1H2A��Һǡ�÷�Ӧ����Na2A��d����Һ����Ҫ��Na2A������NaHA����Һ������Ũ��c��Na+����c��A2-����c��HA-������D��ȷ��
��ѡC��
���� ���⿼����ͼ��仯�ķ�������Ӧ��Һ����ԡ�����ˮ��ԭ�����������Һ������Ũ�ȴ�С�ıȽϷ�����֪ʶ����Ŀ�ѶȽϴ����ڿ���ѧ���ķ��������ͼ���������ע�����ͼ���еĵ��Ӧ�����ʣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
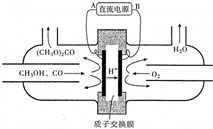 ��1����425�桢A12O3���������״��백����Ӧ�����Ƶö��װ���CH3��2NH�����װ��������ԣ������ᷴӦ���ɣ�CH3��2NH2Cl����Һ�и�����Ũ���ɴ�С��˳��Ϊc��Cl-����c[��CH3��2NH2+]��c��H+����c��OH-����
��1����425�桢A12O3���������״��백����Ӧ�����Ƶö��װ���CH3��2NH�����װ��������ԣ������ᷴӦ���ɣ�CH3��2NH2Cl����Һ�и�����Ũ���ɴ�С��˳��Ϊc��Cl-����c[��CH3��2NH2+]��c��H+����c��OH-�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
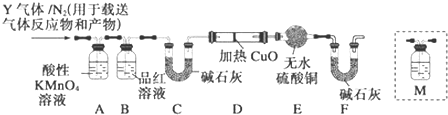
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
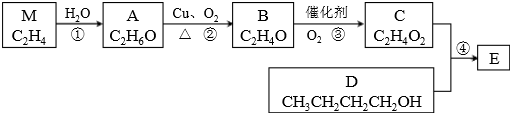
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Fe��NO3��2��KI�����Һ�м�������ϡ���3Fe2++4H++NO3-=3Fe3++2H2O+NO�� | |
| B�� | �ǽ���Ԫ���γɵĻ�����һ���ǹ��ۻ����� | |
| C�� | SO2ͨ��Ca��ClO��2��Һ�У�SO2+Ca2++ClO-+H2O=CaSO4��+2H++Cl- | |
| D�� | ֻ���й��ۼ�������һ���ǹ��ۻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��һ���¶��£�������ijһ��Ӧ��M��N�����ʵ����淴Ӧʱ��仯��������ͼ�����б�������ȷ���ǣ�������
��һ���¶��£�������ijһ��Ӧ��M��N�����ʵ����淴Ӧʱ��仯��������ͼ�����б�������ȷ���ǣ�������| A�� | ��Ӧ�Ļ�ѧ����ʽΪ��N?2M | |
| B�� | t2ʱ�����淴Ӧ������ȣ��ﵽƽ�� | |
| C�� | t3ʱ������Ӧ���ʵ����淴Ӧ���� | |
| D�� | t3���������¶���Ӧ���ʲ�һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
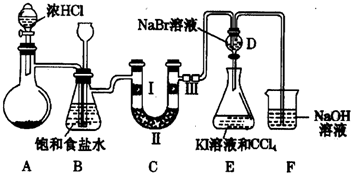
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com