
| A. | +184.6 kJ/mol | B. | -92.3 kJ/mol | C. | -369.2 kJ/mol | D. | +92.3 kJ/mol |
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,lmoI丙烷共用电子对数为10 NA | |
| B. | 0.5 moI甲烷和0.5 mol乙酸完全燃烧消耗的O2分子数都为0.2NA | |
| C. | 标准状况下,1L辛烷充分燃烧后生成气态产物的分子数为$\frac{8}{22.4}$NA | |
| D. | 1 mol甲醇与足量钠反应,转移电子数目为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
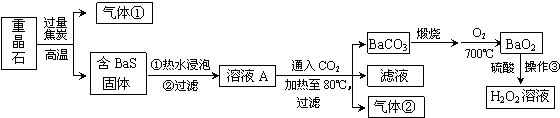
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧化铁与稀硫酸反应:Fe2O3+6H+═Fe2++3H2O | |
| B. | 石灰石溶于盐酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 硫酸铜溶液与氢氧化钠溶液混合:Cu2++2OH-═Cu(OH)2↓ | |
| D. | 碳酸氢钙溶液与盐酸反应:HCO3-+H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
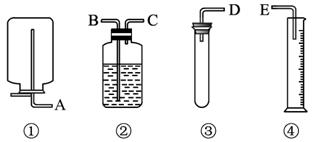 现有药品和如图装置:质量为wg的锌片、稀H2SO4、无水硫酸铜和蒸馏水,
现有药品和如图装置:质量为wg的锌片、稀H2SO4、无水硫酸铜和蒸馏水,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、OH-、CO32- | |
| B. | 在含等物质的量的FeBr2、FeI2溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| C. | 在含等物质的量的KOH、Ba(OH)2溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3 | |
| D. | 在含等物质的量的Fe3+、Cu2+、H+溶液中加入锌粉:Fe3+、Cu2+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com