
 电石的主要成分为CaC2,易与水反应生成C2H2,故C2H2俗称电石气.某同学设计如下方案测定电石中CaC2的纯度(杂质不参加反应).
电石的主要成分为CaC2,易与水反应生成C2H2,故C2H2俗称电石气.某同学设计如下方案测定电石中CaC2的纯度(杂质不参加反应).| 1.2g |
| 64g/mol |
| 1.2g |
| 64g/mol |
| 0.336L |
| 22.4L/mol |
| 0.03mol |
| 0.1mol/L |
| 0.96g |
| 1.2g |


科目:高中化学 来源: 题型:
| A、铁表面镀铜,铁作阳极 |
| B、明矾水解形成的Al(OH)3 胶体能吸附水中悬浮物,可用于水的净化 |
| C、钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-═4OH- |
| D、在轮船外壳上镶入锌块,可减缓船体的腐蚀速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中导电粒子的数H减少 |
| B、醋酸的电离程度增大,c( H+)亦增大 |
| C、稀释后的溶液可消耗NaOH的物质的量不变 |
| D、再加入10 mL pH=11的NaOH溶液,混合液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定有甲烷 |
| B、一定没有丙烷 |
| C、可能有丁烷 |
| D、一定有乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
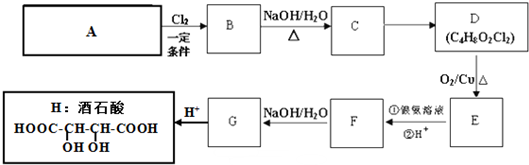

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol |
| B、大于或等于0.2mol,小于0.3mol |
| C、0.2mol |
| D、大于0.1mol小于0.3mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com