
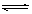 Al(OH)3+3H+由于加热会促进Al3+的水解,同时产生的HCl受热逸出,故用热水配制时水解产生的Al(OH)3增多会出现浑浊现象(3分)
Al(OH)3+3H+由于加热会促进Al3+的水解,同时产生的HCl受热逸出,故用热水配制时水解产生的Al(OH)3增多会出现浑浊现象(3分) Al(OH)3↓+3H+ 温度升高,Al3+水解程度增大,要消除浑浊现象,又不污染药品,可加入适量的盐酸,抑制Al3+水解。
Al(OH)3↓+3H+ 温度升高,Al3+水解程度增大,要消除浑浊现象,又不污染药品,可加入适量的盐酸,抑制Al3+水解。

 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
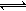 HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7。则下列判断正确的是( )
HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7。则下列判断正确的是( )| A.当过量的碱进入血液中时,发生的反应只为:HCO3-+OH-=CO32-+H2O |
| B.由题给数据可算得正常人血液的pH约为7.4 |
| C.血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) |
| D.正常人血液内不会存在以HCO3-/CO32-为主的缓冲体系 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaHCO3溶液中:c(H+) + c(H2CO3) = c(CO32?) + c(OH?) |
| B.NaHCO3溶液与NaOH溶液混合时,反应的离子方程式为:HCO3?+ OH?= CO2↑ + H2O |
| C.0.2mol·L?1 HCl溶液与等体积0.05 mol·L?1 Ba(OH)2溶液混合后,溶液的pH=1 |
| D.无色透明的酸性溶液中,Fe3+、K+、SO42?、NO3?能大量共存 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.c(Na+)>c(IO4-)>c(OH-)>c(H+) | B.c(IO4-)>c(Na+)>c(OH-)>c(H+) |
| C.c(Na+)>c(OH-)>c(IO4-)>c(H+) | D.c(IO4-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com