
分析 Ⅰ.依据热化学方程式和盖斯定律计算得到所需热化学方程式;
Ⅱ.常温下属于氧化还原反应的放热反应,可设计为原电池,存在元素化合价变化的反应为氧化还原反应;根据正极氧气放电与氢离子反应生成水;
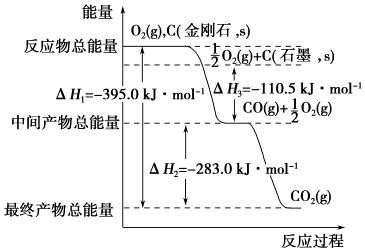
Ⅲ.①依据物质能量越高,物质越不稳定;依据图象判断石墨的燃烧热;
②依据极值计算判断生成的气体组成,结合热化学方程式计算得到.
解答 解:Ⅰ.已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=a kJ•mol-1 ①
CO(g)+l/2O2(g)=CO2(g)△H=b kJ•mol-1 ②
C(石墨)+O2(g)=CO2(g)△H=c kJ•mol-1 ③
依据热化学方程式和盖斯定律:③×6-②×6-①×2得到:4Fe(s)+3O2(g)=2Fe2O3(s)△H=(6c-6b-2a) kJ/mol,
故答案为:6c-6b-2a;
Ⅱ.A.C(s)+CO2(g)=2CO(g)△H>0为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0不属于氧化还原反应,不能设计为原电池,故B错误;
C.2H2O(l)=2H2(g)+O2(g)△H>0为氧化还原反应,但为吸热反应,不能设计为原电池,故C错误;
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H<0为氧化还原反应,为放热反应,能设计为原电池,故D正确;
正极氧气放电与氢离子形成水,正极反应式为:O2+4H++4e-=2H2O,
故答案为:D;O2+4H++4e-=2H2O;
Ⅲ.①图象分析金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,图象分析1mol石墨完全燃烧生成1mol二氧化碳放出的热量为393.5kJ,则石墨的燃烧热为393.5kJ?mol-1;
故答案为:石墨;393.5kJ?mol-1;
②12g石墨物质的量为1mol,在一定量空气中燃烧,依据元素守恒,若生成二氧化碳质量为44g,若生成一氧化碳质量为28g,生成气体36g,28g<36g<44g,判断生成的气体为一氧化碳和二氧化碳气体,设一氧化碳物质的量为x,二氧化碳物质的量为(1-x)mol,28x+44(1-x)=36g,x=0.5mol,二氧化碳物质的量为0.5mol;依据图象分析,C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 ;C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ•mol-1
生成二氧化碳和一氧化碳混合气体放出热量=393.5 kJ•mol-1 ×0.5mol+110.5 kJ•mol-1 ×0.5mol=252KJ;12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为252.0kJ;
故答案为:252.0 kJ.
点评 本题考查了反应热的计算、盖斯定律的运用、原电池等知识点,注重了高考的热点知识的考查,有利于学生巩固基础知识和基本技能,注意原电池的设计为该题的难点,题目难度中等.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 因SiO2不溶于水,故H2SiO3不是SiO2对应的酸,或者说SiO2不是H2SiO3的酸酐 | |
| B. | CO2通入Na2SiO3溶液中可以得到硅酸 | |
| C. | 因为高温时SiO2与Na2CO3反应生成CO2,故硅酸的酸性比碳酸强 | |
| D. | 硅的性质稳定,所以在自然界中可以以游离态存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各物质的量浓度之比为c(A):c(B):c(C)=2:3:3 | |
| B. | 正逆反应速率相等且等于零 | |
| C. | 平衡混合物中各物质的量浓度相等 | |
| D. | 单位时间内,若消耗了amolA物质,则同时也消耗了1.5amolC物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液的导电能力一定比氨水强 | |
| B. | 中和等体积、等物质的量浓度的盐酸和醋酸,需要等量的NaOH | |
| C. | 若盐酸的浓度是醋酸浓度的两倍,则盐酸的c(H+)也是醋酸c(H+)的两倍 | |
| D. | 将NaOH溶液和氨水各稀释一倍,两者的c(OH-)均减小到原来的一半 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性P<S | |
| B. | Na3PO4溶液呈碱性,Na2SO4溶液呈中性 | |
| C. | H3PO4溶液的导电能力弱于H2SO4溶液 | |
| D. | H2SO4溶液与Na3PO4反应可以生成H3PO4和Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 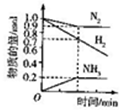 | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 盐酸 | (NH4)2SO4溶液 | |
| 由水电离出的氢离子浓度 | 1.0×10-amol•L-1 | 1.0×10-b mol•L-1 |
| A. | 盐酸中水的离子积大于(NH4)2SO4溶液中水的离子积 | |
| B. | 盐酸和硫酸铵溶液均抑制了水的电离 | |
| C. | 盐酸的pH=a | |
| D. | 在(NH4)2SO4溶液中:c(NH4+)+c(NH3•H2O)=2c(SO42-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com