
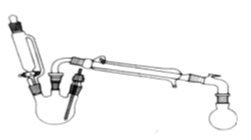
【题目】某研究性小组探究乙酸乙酯的反应机理,实验如下:
CH3COOH + C2H5OH ![]() CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
投料 1 : 1 CH3COOH转化率 65%
1 : 10 CH3COOH转化率 97%
(在120 ℃下测定)
已知:相关物理性质(常温常压)
密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
乙醇 | 0.79 | -114 | 78 | 溶 |
乙酸 | 1.049 | 16.2 | 117 | 溶 |
乙酸乙酯 | 0.902 | 84 | 76.5 | 不溶 |
合成反应:
在三颈瓶中加入乙醇5 mL,硫酸5 mL,2小片碎瓷片。漏斗加入乙酸14.3 mL ,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)酯化反应的机理
用乙醇羟基氧示踪
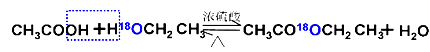
用醋酸羟基氧示踪

含氧18水占到总水量的一半,酯也一样。这个实验推翻了酯化反应为简单的取代反应。请你设想酯化反应的机理 。
2)酯化反应是一个可逆的反应,120 ℃时,平衡常数K= 。
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)浓硫酸与乙醇如何混合? 。
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是? 。
(6)蒸出的粗乙酸乙酯中主要有哪些杂质? 。饱和的Na2CO3溶液洗涤除去乙酸。如何判断是否除净? 。用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水? 。
【答案】(1)先加成反应生成 后消去失水,失水有两种可能分别生成
后消去失水,失水有两种可能分别生成![]() 和
和 
(2)![]()
(3)B
(4)先加入乙醇后加入硫酸,边振荡加滴加。
(5)保证乙醇量是乙酸量10倍以上,提高乙酸的转化率。
(6)乙醚、乙酸、乙醇和水 pH试纸检验不显酸性 减少乙酸乙酯溶解
【解析】
试题分析:(1)根据题给信息知酯化反应的机理是先加成反应生成 后消去失水,失水有两种可能分别生成
后消去失水,失水有两种可能分别生成![]() 和
和  。
。
(2)利用三段式进行计算。120 ℃时,设起始乙醇和乙酸的浓度均为1mol/L。根据题意知
CH3COOH + C2H5OH![]() CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
起始浓度(mol/L)1 1 0 0
转化浓度(mol/L)0.65 0.65 0.65 0.65
平衡浓度(mol/L)0.35 0.35 0.65 0.65
平衡常数![]() 。
。
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是冷却后补加,选B。
(4)实验室中混合两种液体时,为防止暴沸,先加入乙醇后加入硫酸,边振荡加滴加。
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是保证乙醇量是乙酸量10倍以上,提高乙酸的转化率。
(6)蒸出的粗乙酸乙酯中主要有乙醚、乙酸、乙醇和水等杂质;可利用pH试纸检验混合液体不显酸性来判断乙酸是否除尽;用饱和NaCl溶液洗涤除去残留的Na2CO3溶液而不用水的原因是减少乙酸乙酯溶解。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】现有某混合物的无色透明溶液,可能含有以下离子中的若干种:
Na+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
①第一份加入足量AgNO3溶液有沉淀产生,加足量稀硝酸后沉淀部分溶解;
②第二份加足量NaOH溶液充分加热后,收集到气体0.896L(标准状况);
③第三份加足量BaCl2溶液后,过滤后充分干燥得到沉淀6.27g,再经足量稀硝酸洗涤、干燥后,沉淀质量变为2.33g。根据上述实验现象和有关数据,回答下列问题:
(1)原溶液中一定存在的阴离子是 ,一定不存在的离子是 ,可能存在的离子是 。
(2)②中发生化学反应的离子方程式为 。
(3)③中生成可溶于稀硝酸的沉淀化学式为 ,物质的量为 mol,该沉淀溶于稀硝酸的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
元素A、B、C、D、E、F、G在元素周期表中的位置如下图所示,回答下列问题:

(1)G的基态原子核外电子排布式为________。原子的第一电离能:D________E(填“>”或“<”)。
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l-l > l-b > b-b(l为孤对电子对,b为键合电子对),则关于A2C中的A-C-A键角可得出的结论是________。
A.180° B.接近120°,但小于120°
C.接近120°,但大于120° D.接近109°28’,但小于109°28’
(3)化合物G(BC)5的熔点为-20℃,沸点为103℃,其固体属于________晶体,该物质中存在的化学键类型有________,它在空气中燃烧生成红棕色氧化物,反应的化学方程式为________。
(4)化合物BCF2的立体构型为________,其中B原子的杂化轨道类型是________,写出两个与BCF2具有相同空间构型的含氧酸根离子________。
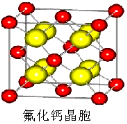
(5)化合物EC的晶胞结构如图所示,晶胞参数a=0.424nm。每个晶胞中含有___________个E2+,列式计算EC晶体的密度(g·cm-3)______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________(写出名称)。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:
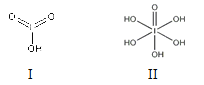
请比较二者酸性强弱:HIO3________H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(6)右图为碘晶体晶胞结构。有关说法中正确的是_________。
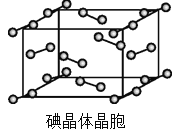
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见右图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用如图所示装置研究电化学原理。下列关于该原电池的说法不正确的是
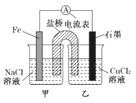
A.原电池的总反应为 Fe+Cu2+=Fe2++Cu
B.反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过0.2 mol电子
C.其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-=H2↑
D.盐桥中是 KNO3溶液,则盐桥中NO3-移向乙烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给出下列氧化还原反应,试回答下列问题。
(1)KMnO4+ KI+ H2SO4 K2SO4+ MnSO4 + I2十 H2O
配平化学反应方程式 被还原的元素 ,发生氧化反应的物质 。
(2)3Cl2 + 6NaOH![]() 5NaCl + NaClO3 + 3H2O
5NaCl + NaClO3 + 3H2O
用双线桥标出电子转移的方向和数目 氧化剂与还原剂的物质的量之比为 ,氧化产物是 。
(3)11P+15CuSO4+24H2O=6H3PO4+15H2SO4+5Cu3P(反应中Cu3P中的P为负三价)。
该反应中Cu2+表现 性(填氧化或还原);11molP中被P氧化的P是 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物中一个碳原子上连有两个羟基时,易脱水形成碳氧双键;物质A~F有如下转化关系:

试回答下列问题:
(1)E中含有的官能团的名称是________,C跟新制的氢氧化铜悬浊液反应的化学方程式为________。
(2)A与NaOH溶液共热时反应的化学方程式为________。
(3)已知B的相对分子质量为162,其燃烧产物中n(CO2)∶n(H2O)=2∶1。则B的分子式为________。
(4)F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应。若F苯环上的一氯代物只有两种,F在一定条件下发生加聚反应的化学方程式为________。
(5)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。则G可能有________种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。
请回答下列问题:
(1)X元素原子基态时的电子排布式为______________,该元素的符号是________;
(2)Y元素原子的价层电子的电子排布图为____________________,该元素的名称是________;
(3)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(4)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性,并说明理由_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应2Fe3++2I-2Fe2++I2设计成如下图所示的原电池。

下列说法不正确的是( )
A.盐桥中的K+移向FeCl3溶液
B.反应开始时,乙中石墨电极上发生氧化反应
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com