
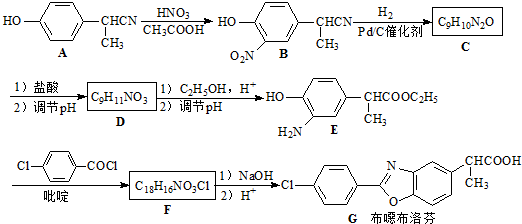

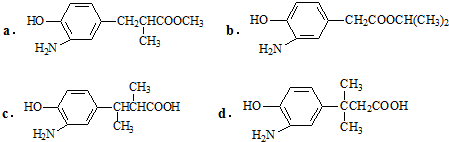
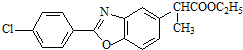
 ;
;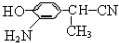 ,结合C、E的结构及D的分子式可知,C中-CN水解为-COOH,故D为
,结合C、E的结构及D的分子式可知,C中-CN水解为-COOH,故D为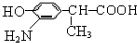 ,D的同分异构体H是一种α-氨基酸,H可被酸性KMnO4溶液氧化成对苯二甲酸,由于酚羟基易被氧化,故H中取代基为HOCH2-、-CH(NH2)COOH,处于对位位置,H通过缩聚反应得到高聚物L.
,D的同分异构体H是一种α-氨基酸,H可被酸性KMnO4溶液氧化成对苯二甲酸,由于酚羟基易被氧化,故H中取代基为HOCH2-、-CH(NH2)COOH,处于对位位置,H通过缩聚反应得到高聚物L. ,
, ;
; ,结合C、E的结构及D的分子式可知,C中-CN水解为-COOH,故D为
,结合C、E的结构及D的分子式可知,C中-CN水解为-COOH,故D为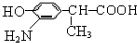 ,D的同分异构体H是一种α-氨基酸,H可被酸性KMnO4溶液氧化成对苯二甲酸,由于酚羟基易被氧化,故H中取代基为HOCH2-、-CH(NH2)COOH,处于对位位置,则H的结构简式是
,D的同分异构体H是一种α-氨基酸,H可被酸性KMnO4溶液氧化成对苯二甲酸,由于酚羟基易被氧化,故H中取代基为HOCH2-、-CH(NH2)COOH,处于对位位置,则H的结构简式是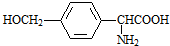 ;聚物L由H通过肽键连接而成,L的结构简式是
;聚物L由H通过肽键连接而成,L的结构简式是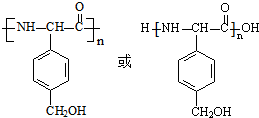 ,
, ;
; .
.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
34 16 |
2 1 |
18 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
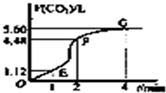 向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定).请回答下列问题:
向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com