
分析 (1)n(CH4)=$\frac{8g}{16g/mol}$=0.5mol,放出445kJ热量,则1molCH4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出890kJ热量,结合焓变为负来解答;
(2)先写出反应的化学方程式并标明物质状态,然后根据放热反应焓变为负值写出反应的热化学方程式;
(3)n(CO)=$\frac{12g}{12g/mol}$=1mol,放出110.5kJ热量,则1molC(s)与适量O2(g)反应生成CO(g),放出110.5kJ热量,结合焓变为负来解答;
(4)先写出反应的化学方程式并标明物质状态,然后根据放热反应焓变为负值写出反应的热化学方程式;
(5)先写出反应的化学方程式并标明物质状态,然后根据吸热反应焓变为正值写出反应的热化学方程式;
(6)根据热化学方程式的书写方法书写,吸热反应中焓变为正值.
解答 解:(1)n(CH4)=$\frac{8g}{16g/mol}$=0.5mol,放出445kJ热量,则1molCH4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出890kJ热量,则甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ•mol-1,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ•mol-1;
(2)CO(g)还原2mol Fe2O3(s)放热49.6KJ,则还原1mol Fe2O3(s)放热24.8KJ,故反应的热化学方程式为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol;
(3)n(CO)=$\frac{12g}{12g/mol}$=1mol,放出110.5kJ热量,则1molC(s)与适量O2(g)反应生成CO(g),放出110.5kJ热量,故该反应的热化学方程式是C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol,
故答案为:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol;
(4)1mol Cl2和1mol H2置于密闭容器中,生成2molHCl,放热183kJ,故该反应的热化学方程式是Cl2(g)+H2(g)=2HCl(g)△H=-183kJ/mol,
故答案为:Cl2(g)+H2(g)=2HCl(g)△H=-183kJ/mol;
(5)1mol HgO(s)分解生成液态汞和氧气时,吸热90.7kJ,故该反应的热化学方程式是HgO(s)=Hg(s)+$\frac{1}{2}$O2(g)△H=+90.7kJ/mol,
故答案为:HgO(s)=Hg(s)+$\frac{1}{2}$O2(g)△H=+90.7kJ/mol;
(6)2mol C与2mol水蒸气反应生成2mol CO和2mol H2,吸热263kJ,则1molC与1mol水蒸气反应生成1mol CO和1mol H2,吸收131.5kJ的热量,则热化学方程式为:C(S)+H2O(g)?CO(g)+H2(g)△H=+131.5kJ•mol-1,
故答案为:C(S)+H2O(g)?CO(g)+H2(g)△H=+131.5kJ•mol-1.
点评 本题主要考查了热化学方程式的书写,题目难度中等,注意掌握书写热化学方程式的方法:标注物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 在25℃时,将amol•L-1的氨水与0.01 mol•L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3•H2O的电离常数:Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| B. | 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应生成Z,平衡后测得X、Y的转化率与起始时两物质的物质的量之比n(X)/n(Y>的关系如图所示,则x与Y的反应方程式可表示为:X+3Y?nZ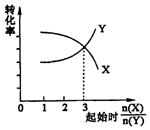 | |
| C. | 某同学在实验室进行了如图所示的实验,则Y中反应的离子方程式为:3CaCO3+2Fe3++3H2O═2Fe(OH)3+3CO2↑+3Ca2+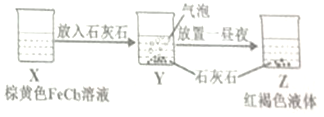 | |
| D. | 将10mL 1 mol•L-1Na2CO3溶液逐滴滴加到10mL1mol•L-1盐酸中,滴加结束后生成的溶液中有:C(Na+)>c(Cl-)>c(CO32-)>c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 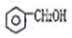 醇类-OH 醇类-OH | B. | CH3CH2COOH 羧酸类-COOH | ||
| C. | 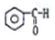 酮类-CHO 酮类-CHO | D. | CH3CH2Br 卤代烃类-Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
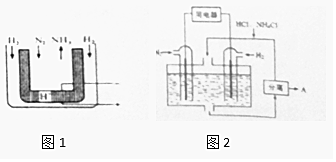 氮及其化合物与人类的生产、生活息息相关.
氮及其化合物与人类的生产、生活息息相关.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定序号[来源:学科网] | 待测液体积(mL) | 所消耗标准盐酸的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
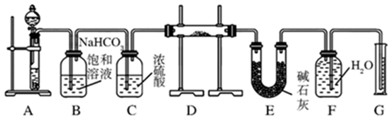
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质的失电子能力随着原子序数的增加而减小 | |
| B. | 从上到下,卤素原子的电子层数依次增多,半径依次减小 | |
| C. | 从F到I,原子核对最外层电子的吸引能力依次减弱,原子的得电子能力依次减弱 | |
| D. | 碱金属单质都是强氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com