
| X | A | M |
| Y | Z | N |
| A. | X的单质在空气中可以燃烧 | |
| B. | X、Y、Z三种元素中Y元素形成的单核阴离子半径最大 | |
| C. | 其最高价氧化物对应的水化物酸性最强的是A元素 | |
| D. | A单质通入NaZ溶液中,根据反应现象可证明A、Z非金属性的相对强弱 |
分析 由短周期元素在周期表的位置可知,A为第二周期元素,A元素原子的最外层电子数比其电子层数的3倍还多,A的电子层数为2,最外层电子数为7,A应为F元素,则X为O元素,M为Ne元素,Y为S元素,Z为Cl元素,N为Ar元素,结合元素对应的单质、化合物的性质以及元素周期律的递变规律解答该题.
解答 解:由上述分析可知,X为O,A为F,M为Ne,Y为S,Z为Cl,N为Ar,
A.X的单质不能燃烧,为助燃剂,故A错误;
B.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则X、Y、Z三种元素中Y元素形成的单核阴离子半径最大,故B正确;
C.O、F无正价,最高价氧化物对应的水化物酸性最强的是Z元素,故C错误;
D.A单质通入NaZ溶液中,F2与水反应生成HF与O2,不能置换出氯,不能证明A、Z非金属性的相对强弱,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素在周期表的位置、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,选项D为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥⑦⑧ | B. | ③⑥⑧ | C. | ④⑥⑦ | D. | ④⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知t℃时AgCl的Ksp=2×10-10,Ag2CrO4(橙红色固体)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
已知t℃时AgCl的Ksp=2×10-10,Ag2CrO4(橙红色固体)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | 在t℃时,Ag2CrO4的Ksp为1×10-9 | |
| B. | 在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y 点到X点 | |
| C. | 在t℃时,AgCl的溶解度大于Ag2CrO4 | |
| D. | 在t℃时,以0.01 mol/L AgNO3溶液滴定20mL未 知浓度的KCl溶液,可用K2CrO4做指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | X | T | Y | Z | W | M | N |
| 主要化合价 | +1 | -2 | -1 | +1 | +2 | +2、-2 | +7、-1 |
| 结构或用途 | 原子半径最小 | 地壳中含量最高的元素 | 非金属性最强 | 一种含氧化物可用作供氧剂 | 次外层电子数是最外层电子数的4倍 |
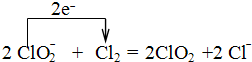 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 只含H、N、O三种元素的化合物,可能是离子化含物,也可能是共价化合物 | |
| B. | 元素周期表中,ⅠA族与ⅦA族元素间只能形成离子化合物 | |
| C. | NaHCO3、CH3COONa均含有离子键和共价键 | |
| D. | 化合物MgO、SiO2、SO3中化学键的类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③正确 | B. | 都不正确 | ||
| C. | ⑥⑦正确,其它不正确 | D. | 仅③正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 过量铁粉与一定量稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 用热的浓盐酸除去试管内壁的MnO2:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| D. | 澄清石灰水中加入过量NaHCO3溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com