
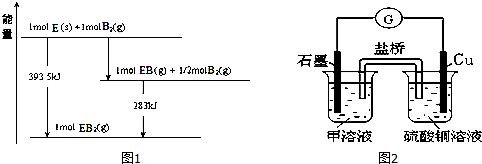
 铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读如图,K闭合时下列判断不正确的是( )
铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读如图,K闭合时下列判断不正确的是( )| A. | d电极:PbSO4+2H2O-2e-=PbO2+4H++SO42- | |
| B. | 当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol | |
| C. | Ⅱ中SO42-向c电极迁移 | |
| D. | K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极 |
分析 K闭合时,Ⅰ装置是原电池,Ⅱ是电解池,则a为正极、b为负极、c为阴极、d为阳极,以此可书写电极反应式,其中b电极反应为Pb-2e-+SO42-=PbSO4 ,a电极反应为PbO2+2e-+4H++SO42-=PbSO4+2H2O,c电极反应为PbSO4+2e-=Pb+SO42-,d电极方程式为PbSO4+2H2O-2e-=PbO2+4H++SO42-,以此解答该题.
解答 解:A.K闭合时Ⅰ为原电池,Ⅱ为电解池,Ⅱ中发生充电反应,d电极为阳极发生氧化反应,其反应式为PbSO4+2H2O-2e-=PbO2+4H++SO42-,故A正确;
B.在Ⅰ装置总反应式中Pb+PbO2+2H2SO4=2H2O+2PbSO4,得失电子总数为2e-,当电路中转移0.2mol电子时,可以计算出Ⅰ中消耗的硫酸的量为0.2mol,故B正确;
C.当k闭合时Ⅰ为原电池,Ⅱ为电解池,Ⅱ中c电极上的PbSO4转化为Pb和SO2-4,d电极上的PbSO4转化为PbO2和SO42-,故SO42-从两极上脱离下来向四周扩散而并非做定向移动,故C错误;
D.K闭合一段时间,也就是充电一段时间后Ⅱ可以作为原电池,由于c表面生成Pb,放电时做电源的负极,d表面生成PbO2,做电源的正极,故D正确.
故选C.
点评 本题综合考查原电池和电解池知识,注意把握电极反应式的书写,为解答该题的关键,学习中要把握原电池和电解池的工作原理.


科目:高中化学 来源: 题型:解答题
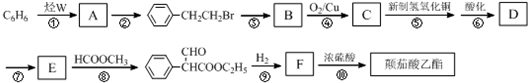
| … | E | A | B | ||
| C | … | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
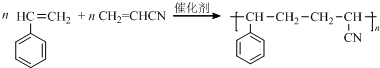 .
. .
.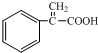 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 对CO(g)+NO2(g)═CO2(g)+NO(g)平衡体系增大压强可使其颜色变深 | |
| C. | 常温下,将1mLpH=3的醋酸溶液加水稀释到100mL,测得其pH<5 | |
| D. | 实验室中常用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Kw/c(H+)=1 mol•L-1的溶液中:Na+、SiO32-、I-、CO32- | |
| B. | 氨水中:Al3+、K+、F-、NO3- | |
| C. | pH=1的溶液中:NH4+、Na+、SO42-、CH3COO- | |
| D. | 0.1 mol•L-1的NaHSO4溶液中:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中H2O2被氧化 | |
| B. | CNO-中N的化合价为-3价 | |
| C. | 温度越高越有利于该反应发生 | |
| D. | 每生成1.8 g H2O,转移电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏操作时,冷凝水的方向应当由下往上 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| C. | 蒸馏时,应使温度计水银球位于蒸馏烧瓶的支管口处 | |
| D. | 分液操作时,首先要打开分液漏斗的上口瓶塞,或使瓶塞上的凹槽与上口部的小孔对准,然后进行分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ①③ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com