
 (1)根据要求填空:
(1)根据要求填空:
分析 (1)a.Cu元素原子核外电子数为29,根据能量最低原理书写核外电子排布式;
b.MgCl2由镁离子与氯离子构成;
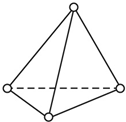
(2)a.P4分子为正四面体型分子,每个面为正三角形;
b.P4分子中有6个P-P键;
c.P4分子为对称结构,属于非极性分子;
(3)中心原子或离子提供空轨道,配体提供孤电子对.
解答 解:(1)a.Cu元素原子核外电子数为29,核外电子排布式为[Ar]3d104s1,故答案为:[Ar]3d104s1;
b.MgCl2由镁离子与氯离子构成,电子式为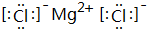 ,故答案为:
,故答案为: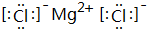 ;
;
(2)a.P4分子为正四面体型分子,每个面为正三角形,分子中P-P键之间的夹角为60°,故答案为:60°;
b.P4分子中有6个P-P键,1mol P4分子中有6mol P-P键,故答案为:6;
c.P4分子为对称结构,属于非极性分子,故答案为:非极性;
(3)a.[Ag(NH3)2]+的中心离子为Ag+,配体为NH3,故答案为:NH3;
b.[AlF6]3-:的中心离子为Al3+,配体为F-,故答案为:F-.
点评 本题考查核外电子排布、电子式、分子结构、化学键、配合物等,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
 合理使用药物是保证身心健康、提高生活质量的有效手段.药物化学已经成为化学的一个重要领域.
合理使用药物是保证身心健康、提高生活质量的有效手段.药物化学已经成为化学的一个重要领域.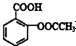 是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为:
是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为: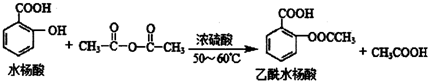
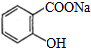 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定.当滴定到消耗20mlHCl时所得溶液中离子浓度间的关系有:5c(Cl-)=4c(HCO3-)+4c(CO32-)+4c(H2CO3) | |
| B. | 常温下,pH=12的氨水与pH=2的盐酸等体积混合溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | 25℃时,0.1 mol•L-1pH=4.5的NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-) | |
| D. | 常温下,等浓度的CH3COONa和CH3COOH混合溶液:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为稀硫酸能与铁反应放出H2,所以稀硝酸与铁反应也一定能放出H2 | |
| B. | 因为Mg可以与水反应放出H2,所以Ca也可以与水反应放出H2 | |
| C. | 因为CO2的水溶液可以导电,所以CO2是电解质 | |
| D. | 因为SO2可以使酸性KMnO4溶液褪色,所以SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
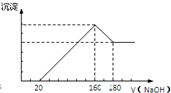 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g) 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com