
已知25 ℃时,难溶化合物的饱和溶液中存在着溶解平衡,例如:AgCl(s)Ag+(aq)+Cl-(aq),Ag2CrO4(s)2Ag+(aq)+CrO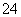 (aq),且Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12。
(aq),且Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12。
(1)若把足量的AgCl分别放入①100 mL蒸馏水,②100 mL 0.1 mol·L-1 NaCl溶液,③100 mL 0.1 mol·L-1 AlCl3溶液,④100 mL 0.1 mol·L-1 MgCl2溶液中,搅拌后在相同温度下Ag+浓度由大到小的顺序是____________________________(填序号)。
(2)现用0.001 mol·L-1 AgNO3溶液滴定0.001 mol·L-1 KCl和0.001 mol·L-1 K2CrO4的混合溶液,试通过计算回答:Cl-和CrO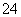 中哪种先沉淀?________。
中哪种先沉淀?________。
答案 (1)①>②>④>③
(2)Cl-
解析 (1)蒸馏水、NaCl溶液、AlCl3溶液和MgCl2溶液中,c(Cl-)从小到大的顺序是①<②<④<③。由题给条件知:当AgCl沉淀溶解达到平衡时,Ag+和Cl-物质的量浓度之积为一定值,可见溶液中c(Cl-)越小,AgCl在其中的溶解度越大,故c(Ag+)由大到小的顺序为①>②>④>③。(2)要形成AgCl沉淀,溶液中Ag+最低浓度c1(Ag+)=1.8×10-7 mol·L-1,要形成Ag2CrO4沉淀,溶液中Ag+最低浓度c2(Ag+)= 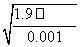 mol·L-1=4.36×10-5 mol·L-1,c1(Ag+)<c2(Ag+),因此Cl-先沉淀。
mol·L-1=4.36×10-5 mol·L-1,c1(Ag+)<c2(Ag+),因此Cl-先沉淀。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
根据下图,下列判断中正确的是( )

A.烧杯a中的溶液pH降低
B.烧杯b中发生氧化反应
C.烧杯a中发生的反应为2H++2e-===H2↑
D.烧杯b中发生的反应为2Cl--2e-===Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
已知溶液中存在平衡:
Ca(OH)2(s)Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是( )
①升高温度,平衡逆向移动
②向溶液中加入少量碳酸钠粉末能增大钙离子浓度
③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液
④恒温下向溶液中加入CaO,溶液的pH升高
⑤给溶液加热,溶液的pH升高
⑥向溶液中加入Na2CO3溶液,其中固体质量增加
⑦向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
A.①⑥ B.①⑥⑦
C.②③④⑥ D.①②⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下。下列说法正确的是( )
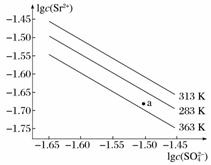
A.温度一定时,Ksp(SrSO4)随c(SO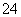 )的增大而减小
)的增大而减小
B.三个不同温度中,313 K时Ksp(SrSO4)最大
C.283 K时,图中a点对应的溶液是饱和溶液
D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
在溶液中有浓度均为0.01 mol·L-1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:Ksp[Fe(OH)3]=2.6×10-39;Ksp[Cr(OH)3]=7.0×10-31;Ksp[Zn(OH)2]=1.0×10-17;Ksp[Mg(OH)2]=1.8×10-11。当氢氧化物开始沉淀时,下列离子中所需pH最小的是( )
A.Fe3+ B.Cr3+ C.Zn2+ D.Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电子排布图的表述正确的是( )
A. 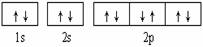 可表示单核10电子粒子基态时电子排布
可表示单核10电子粒子基态时电子排布
B. 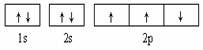 此图错误,违背了泡利原理
此图错误,违背了泡利原理
C.  表示基态N原子的价电子排布
表示基态N原子的价电子排布
D. 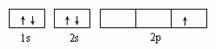 表示处于激发态的B的电子排布图
表示处于激发态的B的电子排布图
查看答案和解析>>
科目:高中化学 来源: 题型:
有关氢键的叙述正确的是( )
A.每一个水分子内平均含有两个氢键
B.氢键与配位键一样,也是共价键的一种
C.氢键是导致浓硫酸具有粘稠性原因之一
D.由于H2O中含有氢键,因此水是一种非常稳定的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量的氧化铁杂质。具体实验流程如下:
明矾石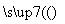

请回答下列问题:
(1)操作1所用到的玻璃仪器的名称是____________。
(2)由溶液3制取氢氧化铝的离子方程式为_______________________________
________________________________________________________________________。
(3)明矾石焙烧时产生SO2,请你写出能验证SO2具有还原性且实验现象明显的化学方程式:______________。
(4)请你写出验证溶液1中有NH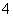 的实验过程:________________________。
的实验过程:________________________。
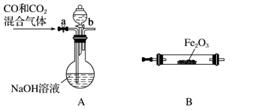
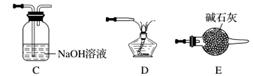
(5)实验室用Fe2O3与CO反应来制取单质Fe。
①请按气流由左到右的方向连接下列各装置,顺序为A→________。
②检查装置A气密性的方法是___________________________________________。
③在点燃B处的酒精灯前,应进行的操作是__________________。
④装置C的作用是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用催化剂可使NO和CO发生反应:2NO(g)+2CO(g)2CO2(g)+N2(g) ΔH<0。已知增大催化剂的比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面的表中。
| 实验编号 | T(℃) | NO初始浓度(mol·L-1) | CO初始浓度(mol·L-1) | 催化剂的比表面积(m2·g-1) |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 1.2×10-3 | 124 | ||
| Ⅲ | 350 | 82 |
(1)请填全表中的各空格;
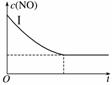
(2)实验Ⅰ中,NO的物质的量浓度(c)随时间(t)的变化如右图所示。请在给出的坐标图中画出实验Ⅱ、Ⅲ中NO的物质的量浓度(c)随时间(t)变化的曲线,并标明各曲线的实验编号。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com