
分析 (1)锌与浓硫酸发生:Zn+2H2SO4=ZnSO4+SO2↑+2H2O,随着反应的进行,硫酸浓度降低,可能发生:Zn+H2SO4=ZnSO4+H2↑,由方程式可知n(Zn)=n(气体)=$\frac{33.6L}{22.4L/mol}$=1.5mol,则n(ZnSO4)=n(Zn)=1.5mol,稀释后溶液pH=1,则剩余硫酸为1L×0.1mol/L×$\frac{1}{2}$=0.05mol,原硫酸的物质的量为0.1L×18.5mol/L=1.85mol,消耗的硫酸为1.85mol-0.05mol=1.8mol,若得到气体只有SO2,根据硫元素守恒则1.5mol+1.5mol=3mol>1.8mol,故气体为SO2、H2的混合物,设反应生成xmolSO2,ymolH2,表示出各反应消耗硫酸物质的量,再结合二者物质的量列方程计算解答;
(2)根据Zn元素化合价变化计算转移电子物质的量;
(3)根据m=nM计算Zn的质量.
解答 解:(1)锌与浓硫酸发生:Zn+2H2SO4=ZnSO4+SO2↑+2H2O,随着反应的进行,硫酸浓度降低,可能发生:Zn+H2SO4=ZnSO4+H2↑,由方程式可知n(Zn)=n(气体)=$\frac{33.6L}{22.4L/mol}$=1.5mol,则n(ZnSO4)=n(Zn)=1.5mol,稀释后溶液pH=1,则剩余硫酸为1L×0.1mol/L×$\frac{1}{2}$=0.05mol,原硫酸的物质的量为0.1L×18.5mol/L=1.85mol,消耗的硫酸为1.85mol-0.05mol=1.8mol,若得到气体只有SO2,根据硫元素守恒则1.5mol+1.5mol=3mol>1.8mol,故气体为SO2、H2的混合物,
设反应生成xmolSO2,ymolH2,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
x 2x x
Zn+H2SO4(稀)=ZnSO4+H2↑
y y y
由题意可得$\left\{\begin{array}{l}{x+y=1.5}\\{2x+y=1.8}\end{array}\right.$
解得:x=0.3mol y=1.2mol
V(SO2)=0.3mol×22.4L/mol=6.72L
V(H2)=1.2mol×22.4L/mol=26.88L,
故答案为:V(SO2)=6.72L、V(H2)=26.88L,
(2)参加反应的Zn为1.5mol,反应中转移电子为1.5mol×2=3mol,
故答案为:3;
(3)参加反应的Zn为1.5mol,消耗Zn的质量为1.5mol×65g/mol=97.5g,
故答案为:97.5.
点评 本题考查方程式的相关计算、氧化还原反应计算,注意根据方程式计算确定Zn与气体的物质的量关系,关键是确定气体的组成,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 6:3:2 | D. | 2:3:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
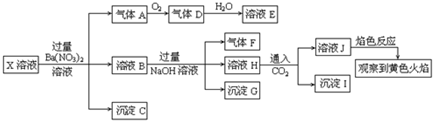
| A. | X中肯定存在Na+、Fe2+、A13+、NH4+、SO42- | |
| B. | 气体F经催化氧化可直接生成气体D | |
| C. | 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I可能有Al(OH )3 | |
| D. | X中不能确定的离子有Na+、K+和C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
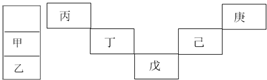
| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,甲和乙的单质均能与水剧烈反应 | |
| D. | 丁的最高价氧化物可广泛可于太阳能电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 | |
| B. | 加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 | |
| C. | 加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 | |
| D. | 加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
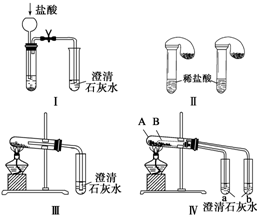
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com