
【题目】工业上产生的氮氧化物可用天然气来处理.
(1)Ⅰ.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1
N2(g)+2O2(g)=2NO2(g)△H2
H2O(l)=H2O(g)△H3
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△ H=(用△ H1、△ H2、△ H3)
(2)Ⅱ.在温度为T1℃和T2℃时,分别将0.50molCH4和1.2molNO2充入体积固定的2L密闭容器中,发生上述可逆反应,测得不同时刻的n(CH4)数据如下表:
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1℃ | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2℃ | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 | 0.15 |
①分析上表中数据,下列说法正确的是
A.T1℃ 前10min,V(NO2)=0.03mol/(Lmin)
B.T1℃ 反应达化学平衡状态时,CH4的转化率为80%
C.T2℃ 反应在40min时处于平衡状态
D.T1>T2
②反应的平衡常数K(T1) K(T2),△H0,理由是 .
③T1℃时反应的平衡常数K为 .
④反应在T1℃下进行,50min时,向平衡后的容器中再通入0.10molCH4和0.40molNO2 , 在下图中画出恒温,重新达到平衡过程中n(CH4)随时间变化的曲线(只要求画出n(CH4)的变化趋势,不需要准确画出再次平衡后n(CH4) .
(3)Ⅲ.NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图.该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为 . 
【答案】
(1)△ H1﹣△ H2+2△ H3
(2)BC;>;<;由表中数据可知,T2时反应速率较大,所以T1<T2;升高温度平衡逆向移动,可知K(T1)>K(T2),所以正反应放热;3.2;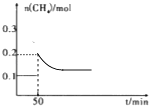
(3)NO2﹣e﹣+NO3﹣=N2O5
【解析】解:Ⅰ.已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1②N2(g)+2O2(g)=2NO2(g)△H2③H2O(l)=H2O(g)△H3根据盖斯定律,①﹣②+③×2可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),则△H=△H1﹣△H2+2△H3 ,
所以答案是:△H1﹣△H2+2△H3;Ⅱ(1)A.前10min内v(CH4)= ![]() =0.0075mol/(L.min),速率之比等于化学计量数之比,则v(NO2)=2v(CH4)=0.015mol/(L.min),故A错误;B.T1℃时,40min反应处于化学平衡状态,可知参加反应甲烷为0.5mol﹣0.1mol=0.4mol,CH4的转化率为
=0.0075mol/(L.min),速率之比等于化学计量数之比,则v(NO2)=2v(CH4)=0.015mol/(L.min),故A错误;B.T1℃时,40min反应处于化学平衡状态,可知参加反应甲烷为0.5mol﹣0.1mol=0.4mol,CH4的转化率为 ![]() ×100%=80%,故B正确;C.T2℃时,反应在40min、50min时甲烷均为0.15mol,则40min处于平衡状态,故C正确;D.前10min内T2℃时参加反应的甲烷越多,反应速率快,故温度T1<T2 , 故D错误,
×100%=80%,故B正确;C.T2℃时,反应在40min、50min时甲烷均为0.15mol,则40min处于平衡状态,故C正确;D.前10min内T2℃时参加反应的甲烷越多,反应速率快,故温度T1<T2 , 故D错误,
故选:BC;(2)前10min内,温度T2℃时参加反应的甲烷更多,故温度T2>T1 , 而平衡时温度T2℃时甲烷的物质的量更大,说明升高温度平衡向逆反应移动,正反应为放热反应,故平衡常数:K(T1)>K(T2),△H<0,所以答案是:>;<;由表中数据可知,T2时反应速率较大,所以T1<T2;升高温度平衡逆向移动,可知K(T1)>K(T2),所以正反应放热;(3)T1℃时,平衡时甲烷为0.1mol,则:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)
开始(mol):0.5 1.2 0 0 0
转化(mol):0.4 0.8 0.4 0.4 0.8
平衡(mol):0.1 0.4 0.4 0.4 0.8
则平衡常数K= ![]() =
=  =3.2,所以答案是:3.2;(4)反应在T1℃下进行,50min时,向平衡后的容器中再通入0.10molCH4和0.40molNO2 , 瞬间甲烷的物质的量变为0.2mol,而后平衡向正反应方向移动,甲烷的物质的量减小,但到达新平衡时甲烷的物质的量大于0.1mol,重新达到平衡过程中n(CH4)随时间变化的曲线的变化趋势:
=3.2,所以答案是:3.2;(4)反应在T1℃下进行,50min时,向平衡后的容器中再通入0.10molCH4和0.40molNO2 , 瞬间甲烷的物质的量变为0.2mol,而后平衡向正反应方向移动,甲烷的物质的量减小,但到达新平衡时甲烷的物质的量大于0.1mol,重新达到平衡过程中n(CH4)随时间变化的曲线的变化趋势:  ,所以答案是:
,所以答案是:  ;
;
Ⅲ.NO2、O2和熔融NaNO3可制作燃料电池,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y为五氧化二氮,石墨I上是二氧化氮失去电子,与硝酸根离子反应生成五氧化二氮,石墨II上是氧气获得电子,与五氧化二氮获反应生成硝酸根,石墨I上电极反应式为:NO2﹣e﹣+NO3﹣=N2O5 , 所以答案是:NO2﹣e﹣+NO3﹣=N2O5 .
【考点精析】利用化学平衡的计算对题目进行判断即可得到答案,需要熟知反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图所示.
实验中可选用的试剂:①处理过的铝箔;②2.0molL﹣1硫酸;③2.0molL﹣1NaOH溶液.
由铝箔制备硫酸铝晶体的实验步骤依次为:
①称取一定质量的铝箔于烧杯中,分次加入2.0molL﹣1NaOH溶液,加热至不再产生气泡为止.
②过滤.
③ .
④过滤、洗涤.
⑤ .
⑥蒸发浓缩.
⑦冷却结晶.
⑧过滤、洗涤、干燥.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
A.②、⑧、⑨对应的简单离子半径依次增大
B.⑥的氯化物的熔点比⑦的氯化物熔点高
C.元素⑩处于常见周期表第四周期第VIIIB族
D.①分别与③、④、⑤均可形成既含极性键又含非极性键的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍具有优良的物理和化学特性,是高技术产业的重要原料. 羰基法提纯镍涉及的反应为:Ni(s)+4CO(g)Ni(CO)4(g)
①当温度升高时, ![]() 减小,则△H0(填“>”或“<”).
减小,则△H0(填“>”或“<”).
②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是(填代号)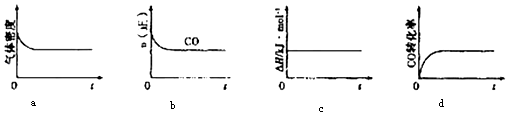
在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数(填“增大”、“不变”或“减小”),反应进行3s后测得Ni(CO)4的物质的量为0.6mol,则0﹣3s内的平均反应速率v(CO)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能用离子方程式 CO ![]() +2H+=CO2↑+H2O表示的反应是( )
+2H+=CO2↑+H2O表示的反应是( )
A.Na2CO3+2HCl=2NaCl+CO2↑+H2O
B.K2CO3+2HNO3=2KNO3+CO2↑+H2O
C.K2CO3+H2SO4=K2SO4+CO2↑+H2O
D.CaCO3+2HCl=CaCl2+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验和分析正确的是( )
A.无色溶液中加入AgNO3溶液得白色沉淀,加稀盐酸不消失,可能存在Cl﹣或SO ![]()
B.无色溶液中滴加BaCl2溶液得白色沉淀,加稀硝酸不溶解,则一定含有SO ![]()
C.用CCl4萃取碘水中的碘,下层呈紫红色
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用有关概念判断下列叙述正确的是( )
A.能够完全电离的电解质称为强电解质,如硫酸、盐酸、氢氧化钠等是强电解质
B.1mol甲烷燃烧放出的热量为甲烷的燃烧热
C.中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应
D.风能是正在探索的新能源之一,它是太阳能的一种转换形式,具有不稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,已知反应mX(g)+nY(g)![]() qZ(g) ΔH>0,m+n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是( )
qZ(g) ΔH>0,m+n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是( )
A. 反应速率v逆(Y)=![]() v正(X) B. 增加Y的物质的量,X的转化率增大
v正(X) B. 增加Y的物质的量,X的转化率增大
C. 降低温度,![]() 的值变小 D. 加入X,反应的ΔH增大
的值变小 D. 加入X,反应的ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是( )
A.将溴水、铁粉和苯混合加热即可制得溴苯
B.除去溴苯中红棕色的溴,可用稀NaOH溶液反复洗涤,并用分液漏斗分液
C.用苯和浓HNO3、浓H2SO4反应制取硝基苯时需水浴加热,温度计应放在混合液中
D.制取硝基苯时,应先取浓H2SO42mL,再加入1.5mL浓HNO3 , 再滴入苯约1mL,然后放在水浴中加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com