过度排放CO
2会造成“温室效应”,为了减少煤燃烧对环境造成的污染,煤的气化是高效、清洁利用煤炭的重要途径.煤综合利用的一种途径如图所示.

(1)已知C(s)+H
2O(g)═CO(g)+H
2(g)△H
1=+131.3kJ?mol
-1,C(s)+2H
2O(g)═CO
2(g)+2H
2(g)△H
2=+90kJ?mol
-1.则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是
.
(2)用如图原电池装置可以完成过程⑤的转化,该装置b电极的电极反应式是
.
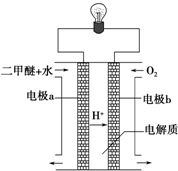
(3)在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H
2在催化剂作用下反应生成甲醇:CO(g)+2H
2(g)?CH
3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
①p
1
p
2(填“>”、“<”或“=”).
②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H
2,达到新平衡时,CO的平衡转化率
(填“增大”、“减小”或“不变”).

③在p
1下,100℃时,CO(g)+2H
2(g)?CH
3OH(g)反应的平衡常数为
(用含a、V的代数式表示).
(4)右上图表示CO
2与H
2反应生成CH
3OH和H
2O的过程中能量(单位为kJ?mol
-1)的变化:
关于该反应的下列说法中,正确的是
(填编号).
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(5)为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO
2和3mol H
2,一定条件下发生反应:CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g),测得CO
2(g)和CH
3OH(g)的浓度随时间变化的曲线如图所示:
①从反应开始到平衡,CO
2的平均反应速率v(CO
2)=
.
②下列措施中能使化学平衡向正反应方向移动的是
(填编号).

A.升高温度
B.将CH
3OH(g)及时液化移出
C.选择高效催化剂
D.再充入1mol CO
2和3mol H
2.







 A、B、C均为中学所学的常见物质且均含有同一种元素,X为金属单质,A为气体单质,它们之间的转化关系如图所示(反应条件及其他物质已经略去):
A、B、C均为中学所学的常见物质且均含有同一种元素,X为金属单质,A为气体单质,它们之间的转化关系如图所示(反应条件及其他物质已经略去): A、B、C、D、E均是中学常见的纯净物.其转化关系如图所示(图中某些生成物已略去),物质A与物质B之间的反应不在溶液中进行,通常状况下D为气体.
A、B、C、D、E均是中学常见的纯净物.其转化关系如图所示(图中某些生成物已略去),物质A与物质B之间的反应不在溶液中进行,通常状况下D为气体.
