
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题:
(1)写出下列元素符号:A______, B_______,C________,D__________。
(2)写出C元素在周期表的位置_________,E2+价电子的轨道表示式______________,B元素能量最高的电子为____轨道上的电子,其轨道呈______形。
(3)按原子轨道的重叠方式,1molA与C形成的最高价化合物中σ键有______个,π键有______个。(阿伏加德罗常数的值用NA表示)
(4)B、C、D的简单离子的半径由大到小的顺序为________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式_____________。
【答案】C N O Al )第2周期第VIA族 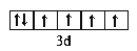 2p 纺锤形(或哑铃形) 2NA 2NA N3->O2->Al3+
2p 纺锤形(或哑铃形) 2NA 2NA N3->O2->Al3+ ![]()
【解析】
A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,由A的基态原子的价电子排布式可以知道,n=2,则A为C元素;C的最外层电子数是电子层数的3倍,则C为O元素;B的基态原子中的未成对电子数是同周期中最多的,可以知道p能级上只有3个电子,结合原子序数可以知道,B为N元素;D为简单离子是第三周期元素中离子半径最小的,则D为Al元素;E的价电子层中的未成对电子数为4,则E为Fe,据以上分析解答。
A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,由A的基态原子的价电子排布式可以知道,n=2,则A为C元素;C的最外层电子数是电子层数的3倍,则C为O元素;B的基态原子中的未成对电子数是同周期中最多的,可以知道p能级上只有3个电子,结合原子序数可以知道,B为N元素;D为简单离子是第三周期元素中离子半径最小的,则D为Al元素;E的价电子层中的未成对电子数为4,则E为Fe;
(1) 由上述分析可以知道,A为C,B为N,C为O,D为Al;综上所述,本题答案是:C,N , O ,Al。
(2)C为O,核电荷数8,在周期表的位于第2周期第VIA族;铁原子基态核外电子排布为:1s22s22p63s23p63d64s2,Fe2+价电子的轨道表示式 ;B为N, 基态核外电子排布为:1s22s22p3,能量最高的电子为2p轨道上的电子,其轨道呈纺锤形(或哑铃形);综上所述,本题答案是:第2周期第VIA族 ,
;B为N, 基态核外电子排布为:1s22s22p3,能量最高的电子为2p轨道上的电子,其轨道呈纺锤形(或哑铃形);综上所述,本题答案是:第2周期第VIA族 , ,2p; 纺锤形(或哑铃形)。
,2p; 纺锤形(或哑铃形)。
(3)按原子轨道的重叠方式,1molC与O形成的最高价化合物为CO2,结构式为O=C=O,含有σ键有2NA 个,π键有2NA 个;综上所述,本题答案是:2NA ,2NA。
(4)具有相同电子结构的离子中原子序数大的离子半径小,则B、C、D的简单离子的半径由大到小的顺序为N3->O2->Al3+;因此,本题正确答案是:N3->O2->Al3+。
(5)C的核外有18个电子的氢化物为过氧化氢,其电子式为![]() ,因此,本题正确答案是:
,因此,本题正确答案是:![]() 。
。


科目:高中化学 来源: 题型:
【题目】氮氧化物(主要为NO和NO2)是大气污染物,如何有效地消除氮氧化物污染是目前科学家们研究的热点问题之一。
(1)用尿素[CO(NH2)2]吸收氮氧化物是一种可行的方法。
①尿素在高温条件下与NO2反应转化成无毒气体,该反应的化学方程式为___________;用尿素溶液也可吸收氮氧化物,研究表明,氮氧化物气体中NO的体积分数越大,总氮被还原率越低,可能的原因是______。
②在一个体积固定的真空密闭容器中充入等物质的量的CO2和NH3,在恒定温度下使其发生反应2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)并达到平衡,混合气体中氨气的体积分数随时间的变化如图所示:
CO(NH2)2(s)+H2O(g)并达到平衡,混合气体中氨气的体积分数随时间的变化如图所示:

则A点的v正(CO2)___________(填“>”“<”或“=”)B点的v逆(H2O),原因是________________。
(2)已知O3氧化氮氧化物的主要反应的热化学方程式如下:2NO(g)+O2(g)=2NO2(g)△H1=akJ·mol-1,NO(g)+O3(g)=NO2(g)+O2(g)△H2=bkJ·mol-1,6NO2(g)+O3(g)===3N2 O5(g)△H3=c kJ·mol-1,则反应4NO2(g)+O2(g)=2N2O5(g)的△H=___________kJ·mol-1。
(3)氮氧化物也可用碱溶液吸收。若NO和NO2混合气体被NaOH溶液完全吸收,只生成一种盐,则该盐的化学式为_______;已知常温下,Ka(HNO2)=5×10-4,则反应HNO2(aq)+NaOH(aq)![]() NaNO2(ag)+H2O(1)的平衡常数K=___________,相同物质的量浓度的HNO2、NaNO2混合溶液中,各离子的物质的量浓度由大到小的顺序为___________。
NaNO2(ag)+H2O(1)的平衡常数K=___________,相同物质的量浓度的HNO2、NaNO2混合溶液中,各离子的物质的量浓度由大到小的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气压对许多物理实验和化学实验有着重要影响。如图是喷泉实验的装置图:

(1)收集氨气应使用___法,要得到干燥的氨气时,用___做干燥剂。
(2)请用相应的方程式解释氨气溶于水后显碱性的原因___。
(3)用如图装置进行喷泉实验,上部烧瓶已装满干燥的氨气,引发水上喷的操作是:___,该实验的原理是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1520℃。
(1)锌离子的电子排布式是_____________。
(2)根据元素周期律,电负性S______Se,第一电离能Se______As(填“>”或“<”)。
(3)H2O的沸点______________(填“>”或“<”)H2Se的沸点,其原因是:______。
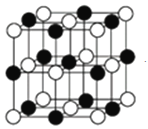
(4)NaCl晶胞如图所示,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。晶胞中Na+的配位数为____,若晶胞参数为a pm,阿伏加德罗常数的值用NA表示,若晶体密度为_______g·cm﹣3。(列出表达式)。
(5)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于_______。若已知铜的原子半径为rcm,表示原子空间占有率的表达式为__________。
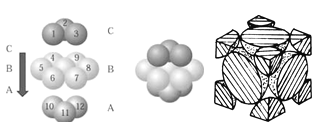
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在体积为5 L的密闭容器中发生可逆反应。(Ⅰ)若某可逆反应的化学平衡常数表达式为:K=![]()
(1)写出该反应的化学方程式:
(2)能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
A.容器中气体的平均相对分子质量不随时间而变化
B.v正(H2O)=v逆(H2)
C.容器中气体的密度不随时间而变化
D.容器中总质量不随时间而变化
E.消耗n mol H2的同时消耗n mol CO
(Ⅱ)若该密闭容器中加入的是2 mol Fe(s)与1 mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35 mol。
(1)t1~t2这段时间内的化学反应速率v(H2)= 。
(2)若继续加入2 mol Fe(s),则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1 mol H2O(g),再次达到平衡后,H2物质的量为 mol。
(3)该反应的逆反应速率随时间变化的关系如图。t1时改变了某种条件,改变的条件可能是 、 (填写2项)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度,回答下列问题:
(1)为什么所用NaOH溶液要稍过量____________________。
(2)倒入NaOH溶液的正确操作是________(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为________。
(5)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,从A处通入Cl2。当关闭B阀时,C处的红布逐渐褪色;当打开B阀后,C处的红布无明显现象,则下列判断正确的是
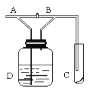
A.通入的Cl2可能是潮湿的B.红布一定是干燥的
C.D中的液体可能是NaOHD.使红布褪色的物质是Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH4+):③>①
B. 水电离出的c(H+):②>①
C. ①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D. ①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com