
| 反应物 | 溴水 | 酸性KMnO4溶液 | 氢硫酸(H2S溶液) | 滴有酚酞的NaOH溶液 | 石蕊试液 | 品红溶液 |
| 反应现象 | ||||||
| SO2的性质 |
分析 二氧化硫为酸性氧化物,能够与水反应生成亚硫酸,能够与氢氧化钠反应生成亚硫酸钠和水;
具有还原性,能够还原溴水、酸性的高锰酸钾;
具有弱的氧化性,能够氧化硫化氢生成硫单质;
具有漂白性,能够使品红褪色.
解答 解:二氧化硫为酸性氧化物,能够与水反应生成亚硫酸,亚硫酸电离生成氢离子,溶液显酸性,石蕊试液变红;能够与氢氧化钠反应生成亚硫酸钠和水,使变红的酚酞溶液褪色;
具有还原性,能够还原溴水使溴水褪色,能够还原酸性的高锰酸钾,使高锰酸钾褪色;
具有弱的氧化性,能够氧化硫化氢生成硫单质,通入到氢硫酸溶液中产生淡黄色沉淀;
具有漂白性,能够使品红褪色;
故答案为:
| 反应物 | 溴水 | 酸性KMnO4溶液 | 氢硫酸(H2S溶液) | 滴有酚酞的NaOH溶液 | 石蕊试液 | 品红溶液 |
| 反应现象 | 溴水褪色 | 酸性KMnO4褪色 | 生成淡黄色沉淀 | 溶液由红色变成无色 | 变红 | 褪色 |
| SO2的性质 | 还原性 | 还原性 | 氧化性 | 酸性 | 酸性 | 漂白性 |
点评 本题考查了元素化合物性质,熟悉二氧化硫的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
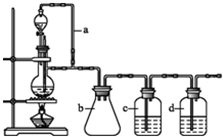

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子序数:X<Y<Z | B. | 气态氢化物稳定性:XH3<YH3<ZH3 | ||
| C. | 元素的非金属性强弱:X>Y>Z | D. | 电子层数:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
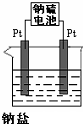 已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):
已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7gH2O2中含有的电子总数为0.9NA | |
| B. | 92g NO2和N2O4的混合气中含有的氮原子数为2NA | |
| C. | 标准状况下,28 g CO与22.4 L O2所含原子数相等 | |
| D. | 1 mol FeCl3完全水解转化为氢氧化铁胶体后生成NA个胶粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
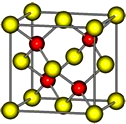 有A、B、C、D、E五种前四周期的元素.A原子核外有1个未成对电子,A+比B原子少一个电子层,B原子得一个电子填入3p轨道后,3p轨道呈全充满状态.C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的核电荷数相差8.E位于周期表第12纵列且是六种元素中原子序数最大的.R是由D、E形成的化合物,其晶胞结构如图所示.请回答下列问题:
有A、B、C、D、E五种前四周期的元素.A原子核外有1个未成对电子,A+比B原子少一个电子层,B原子得一个电子填入3p轨道后,3p轨道呈全充满状态.C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的核电荷数相差8.E位于周期表第12纵列且是六种元素中原子序数最大的.R是由D、E形成的化合物,其晶胞结构如图所示.请回答下列问题: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com