
| A. | 钾 | B. | 铝 | C. | 镁 | D. | 铜 |
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++SO2+2H2O→SO42-+2H++2Fe2+ | B. | I2+SO2+2H2O→H2SO4+2HI | ||
| C. | H2O2+2H++SO42-→SO2↑+O2↑+2H2O | D. | 2Fe3++2I-→2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 金属(粉末状) (mol) | 酸的浓度及体积 | 反应温度(℃) |
| A | Mg,0.1 | 5 mol•L-1 硝酸 10mL | 60 |
| B | Mg,0.1 | 3 mol•L-1 盐酸 10mL | 60 |
| C | Fe,0.1 | 3 mol•L-1 盐酸 100mL | 60 |
| D | Mg,0.1 | 2 mol•L-1 硫酸 5mL | 60 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据实验①可知溶液中不存在CO32-、SiO32- | |
| B. | 该溶液中肯定存在NH4+、Fe2+ | |
| C. | 该溶液中至少含有4种离子 | |
| D. | 另取该溶液,加入适量氯水和淀粉溶液,若溶液显蓝色,即可确定该溶液中含有NH4+、Fe2+、SO42-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
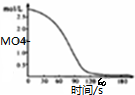
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的硬度大于铝 | B. | 镁的熔沸点高于钙 | ||
| C. | 镁的硬度大于钾 | D. | 钙的熔沸点高于钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化吸收大量的热,可用作制冷剂 | |
| B. | SO2具有还原性,可用作漂白剂 | |
| C. | 晶体硅熔点高硬度大,可用于制作半导体材料 | |
| D. | 常温下浓硫酸具有强氧化性,可用作脱水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com