
【题目】公认的人体必需金属元素是钠和钾。在动物中,钠主要是以氯化钠形式存在于细胞外液中,依靠氯化钠可以把一定量的水吸到细胞里来,使细胞里维持一定的水分。某试剂瓶上贴有如下标签,对该试剂理解正确的是 ( )
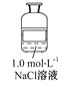
A.该溶液中含有的微粒主要有NaCl、Na+、Cl-、H2O
B.若取50毫升溶液,其中的c(Cl-)=0.05 mol·L-1
C.若取该溶液与100 mL 0.1 mol·L-1AgNO3溶液完全反应,需要取该溶液10 mL
D.该溶液与1.0 mol·L-1Na2SO4溶液的c(Na+)相等
【答案】C
【解析】
A.NaCl在溶液中完全电离出钠离子和氯离子,在溶液中不存在NaCl分子,故A错误;
B.若取50毫升溶液,取出溶液浓度不变,则c(Cl-)=c(NaCl)=1.0mol/L,故B错误;
C.100mL 0.1mol/LAgNO3溶液中:n(AgNO3)=0.1mol/L×0.1L=0.01mol,则需要n(NaCl)=n(AgNO3)=0.01mol,需要该NaCl溶液的体积为:![]() =0.01L=10mL,故C正确;
=0.01L=10mL,故C正确;
D.1.0mol/LNaCl溶液中c(Na+)=1.0mol/L,1.0mol/LNa2SO4溶液中c(Na+)=1.0mol/L×2=2.0mol/L,故D错误;
故答案为C。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】已知某工业废水中含有大量FeSO4,较多的Cu2+,少量的Na+ 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。
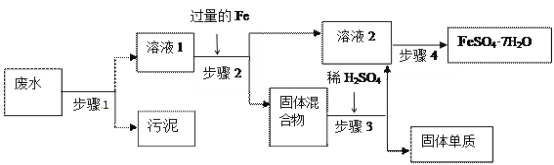
(1)步骤1的主要操作是__,需用到的玻璃仪器除烧杯外有______,_______。
(2)步骤2中发生反应的离子方程式为__________________________________。
(3)步骤3中发生反应的化学方程式为__________________________________。
(4)步骤4中涉及的操作是:蒸发浓缩._____________、过滤、洗涤、烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C—C键可以绕键轴自由旋转,结构简式为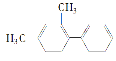 的烃,下列说法中不正确的是( )
的烃,下列说法中不正确的是( )
A.分子中至少有10个碳原子处于同一平面上
B.分子中至少有8个碳原子处于同一平面上
C.分子中至多有14个碳原子处于同一平面上
D.该烃不属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯(C2H6)是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯丙烷、异丙醇等产品。
(1)丙烷脱氢制备丙烯。由图可得C3H8(g)C3H6(g)+H2(g) H=____________kJ/mol
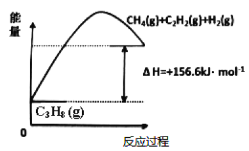
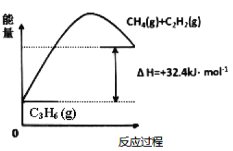
①为了同时提高反应速率和反应物的平衡转化率,可采取的措施是________。
②目前在丙烷脱氢制丙烯时常通入适量的O2,让其同时发生下列反应:2C3H8(g) +O2(g)2C3H6(g)+2H2O(g) H=-235kJ/mol,通入O2的目的是_______。
(2)以C4H8和C2H4为原料发生烯烃歧化反应C4H8(g)+C2H4(g)2C3H6(g) H>0
①某温度下,上述反应中,正反应速率为v正=K正c(C4H8)c(C2H4)、逆反应速率为v逆=K逆c2(C3H6),其中K正、K逆为速率常数,该反应使用WO3/SiO2为催化剂,下列说法中正确的是_____________
A.催化剂参与了歧化反应,但不改变反应历程
B.催化剂使K正和K逆增大相同的倍数
C.催化剂降低了烯烃歧化反应的活化能,增大了活化分子百分数
D.速率常数的大小与反应程度无关系
②已知t1min时达到平衡状态,测得此时容器中n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=bmol,且平衡时C3H6的体积分数为25%。再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数___________25%(填“>”、“<”、“=”)。
(3)工业上可用丙烯加成法制备1,2-二氯丙烷(CH2ClCHClCH3),主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
Ⅰ. CH2=CHCH3(g)+Cl2(g)CH2ClCHClCH3(g)
II. CH2=CHCH3(g)+Cl2(g)CH2=CHCH2Cl(g)+HCl(g)
一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应Ⅰ,容器内气体的压强随时间的变化如表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.2 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2ClCHClCH3)=____________kPamin-1。
,则前120min内平均反应速率v(CH2ClCHClCH3)=____________kPamin-1。
②该温度下,若平衡时HCl的体积分数为12.5%,反应Ⅰ的平衡常数Kp=__________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素以C—C键构成了有机界,硅元素以![]() 键构成了整个矿物界,锗元素是重要的国家战略资源。碳族元素组成了有机界、无机界和当代工业。回答下列问题:
键构成了整个矿物界,锗元素是重要的国家战略资源。碳族元素组成了有机界、无机界和当代工业。回答下列问题:
(1)基态锗(![]() )原子的核外电子排布式为
)原子的核外电子排布式为![]() _____;
_____;![]() 分子空间构型是__________。
分子空间构型是__________。
(2)![]() 发生水解的机理如图:
发生水解的机理如图:

![]() 不能按照上述机理发生水解反应,原因是____________________。
不能按照上述机理发生水解反应,原因是____________________。
(3)金刚石熔点为4440℃,晶体硅熔点为1410℃,金刚石熔点比晶体硅高的原因是_______。
(4)C和![]() 经常形成原子晶体,原子晶体的配位数普遍低于离子晶体,原因是_____。
经常形成原子晶体,原子晶体的配位数普遍低于离子晶体,原因是_____。
(5)在硅酸盐中,![]() 四面体[如图(a)和(b)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(c)为片层状结构的多硅酸根,其中
四面体[如图(a)和(b)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(c)为片层状结构的多硅酸根,其中![]() 原子的杂化方式为______,化学式为_______。
原子的杂化方式为______,化学式为_______。


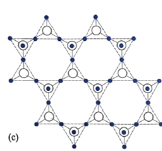
(6)铝硅酸盐分子筛在化工领域有重要的应用。铝硅酸盐结构中![]() 价铝部分地置换
价铝部分地置换![]() 四面体结构中
四面体结构中![]() 价的硅。从结构角度分析
价的硅。从结构角度分析![]() 价铝能够置换
价铝能够置换![]() 价硅的原因是_________。
价硅的原因是_________。
(7)石墨采取六方最密堆积方式,晶胞结构如图。晶胞参数为底边长![]() ,高
,高![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]() ,则石墨晶体的密度为_______
,则石墨晶体的密度为_______![]() 。
。
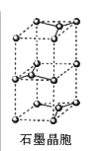
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为室温时不同pH下磷酸钠盐溶液中含磷微粒形态的分布,其中a、b、c三点对应的pH分别为2.12、7.21、12.66,其中δ表示含磷微粒的物质的量分数。下列说法正确的是
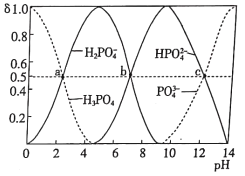
A.选择酚酞作指示剂,用NaOH溶液滴加磷酸溶液的反应为H3PO4+3OH-=PO![]() +3H2O
+3H2O
B.室温下,水电离的c(H+)·c(OH-):a<b<c
C.a、b、c点对应水溶液中c(H3PO4)+c(H2PO![]() )+c(HPO
)+c(HPO![]() )+c(PO
)+c(PO![]() )之和相等
)之和相等
D.室温下,H3PO4的第三级电离常数的数量级为10-12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基)。

则下列有关叙述正确的是( )
A.反应①属于加成反应B.1 mol W最多可与3 mol NaOH反应
C.X、Y、W、Z都能与NaOH溶液反应D.可用溴水或FeCl3溶液鉴别出X和W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸型酸雨的形成原理可简化表示如下:

回答下列问题:
(1)A物质的化学式_________,B物质的化学式_________。
(2)根据SO2的性质,可让工厂的烟道气通过________除去SO2,达到减少污染的目的。
(3)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:

注 溶液的pH越大,H+的物质的量浓度就越小。
①雨水样品的pH变化的原因是____________(用化学方程式表示)。
②如果将刚取样的上述雨水和用氯气消毒的自来水相混合,pH将_________(填“增大”“减小”或“不变”),原因是(用化学方程式表示):_____________。
(4)你认为减少酸雨产生可采用的措施是_________(填序号)。
①少用煤做燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示的反应判断下列说法中错误的是

A. CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量
B. 该反应的焓变大于零
C. 该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量
D. 由该反应可推出凡是需要加热才发生的反应均为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com