
| A、少量的金属铜投入浓硝酸中Cu+4H++2NO3-=Cu2++NO2↑+2H2O |
| B、铝片投入稀盐酸中Al+6H+=Al3++3H2↑ |
| C、氢氧化钡溶液与稀硫酸混合Ba2++SO42-=BaSO4↓ |
| D、氢氧化铝与足量烧碱溶液混合Al(OH)3+OH-=AlO2-+2H2O |


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | 0 | |||||||
| 1 | H | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | ② | F | Ne | |||||
| 3 | ③ | Mg | ④ | Si | ⑤ | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2+NO2→SO3+NO | ||
| B、SO2+2NaOH→H2O+Na2SO3 | ||
C、SO2+2Mg
| ||
| D、SO2+Br2+2H2O→H2SO4+2HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是一种纯净物 |
| B、能产生丁达尔效应 |
| C、分散质粒子的直径在0.01-1nm之间 |
| D、制备方法是将饱和FeCl3溶液滴入煮沸的NaOH溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
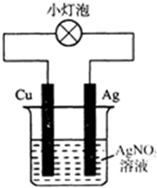
| A、该装置外电路中电流由Cu棒转移到Ag棒 |
| B、该装置中正极是Cu、负极是Ag |
| C、该装置是电解池 |
| D、该装置中正极上的电极反应为Ag++e-═Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 166 |
| 67 |
| 166 |
| 67 |
| A、电子数是166 |
| B、中子数是99 |
| C、质量数是67 |
| D、原子序数是166 |
查看答案和解析>>
科目:高中化学 来源: 题型:
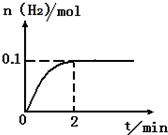 分解水制氢气的工业制法之一是硫--碘循环,主要涉及下列反应:
分解水制氢气的工业制法之一是硫--碘循环,主要涉及下列反应: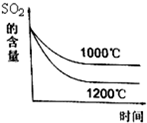 b、
b、
 d、
d、
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com