
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体.在合适反应条件下,它们可以按下面框图进行反应;又知D溶液为黄色,E溶液为无色.请回答:
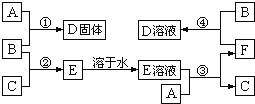
(1)B是_____,F是_____(请填写化学式);
(2)反应③的离子方程式_____;
(3)反应④的离子方程式_____.
【答案】Cl2 FeCl2 Fe+2H+=Fe2++H2↑ 2Fe2++Cl2=2Fe3++2Cl-
【解析】
单质B为黄绿色气体,可知B为Cl2,C为无色气体,B与C反应生成E,E溶液是无色的,则C为H2,E为HCl,A与盐酸生成氢气,A应为金属固体单质,A与盐酸反应后生成F为A的氯化物,F又能与氯气反应生成D,D溶液为黄色,且A与氯气可以直接生成D,可推知A为Fe,根据转化关系可知,F为FeCl2,D为FeCl3,
(1)由以上分析可知,B为Cl2,F为FeCl2,故答案为:Cl2,FeCl2;
(2)反应③为Fe和HCl的反应,反应的离子方程式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(4)反应④为FeCl2和Cl2的反应,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-.


科目:高中化学 来源: 题型:
【题目】工业上氟气可作为火箭燃料中的氧化剂。1886年法国化学家![]() 通过电解氟氢化钾
通过电解氟氢化钾![]() 的氟化氢无水溶液第一次制得氟气。已知:
的氟化氢无水溶液第一次制得氟气。已知:![]() ,制备氟气的电解装置如下图所示。下列说法错误的是( )
,制备氟气的电解装置如下图所示。下列说法错误的是( )

A. 钢电极与电源的负极相连
B. 氟氢化钾在氟化氢中可以电离
C. 阴极室与阳极室必须隔开
D. 电解过程需不断补充的X是KF。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出制备氢氧化铁胶体的化学方程式:___;
(2)写出盐酸除铁锈(主要成分Fe2O3)的离子方程式:___;
(3)写出NaHSO4溶液与Ba(OH)2溶液混合呈中性的离子方程式:___;
(4)写出NaHCO3溶液与少量澄清石灰水反应的离子方程式:___;
(5)写出硫酸铜溶液与氢氧化钡溶液反应的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为_____.
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL 蒸馏水,振荡,恢复至室温,发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论_____.
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中.
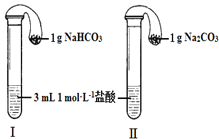
①两试管中均产生气体,_____(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是_____.
a 装置 I的气球体积较大 b 装置Ⅱ的气球体积较大
c 装置 I的气球体积等于装置Ⅱ的气球体积 d 无法判断
(4)同学们将两种固体分别配制成0.5molL﹣1的溶液,设计如下方案并对反应现象做出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2mL Na2CO3溶液中滴加1mL 0.5molL﹣1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32﹣浓度较大,能与CaCl2发生反应__________(写离子方程式). |
操作2:向2mL NaHCO3溶液中滴加1mL 0.5molL﹣1CaCl2溶液 | 无白色沉淀 | Na2CO3溶液中的CO32﹣浓度很小,不能与CaCl2发生反应。 |
操作1反应的离子方程式为________________,实施试验后,发现操作2的现象与预测有差异,产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】拆开1 mol 共价键所吸收的能量或形成1 mol 共价键所释放的能量称为键能。已知:H-H键能为436 kJ /mol,H-N键能为391 kJ /mol, N2 (g)+ 3H2(g) ![]() 2NH3(g) △H=-92.4 kJ /mol,下列说法中正确的是( )
2NH3(g) △H=-92.4 kJ /mol,下列说法中正确的是( )
A. H-H比N≡N更牢固
B. N≡N键能约为946 kJ/mol
C. 合成氨反应选择适当的催化剂是为了提高H2的转化率
D. 0.5 mol N2和1.5 mol H2在题给条件下充分反应,放出热量为46.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、某校化学小组学生利用如图所列装置进行“铁与水反应”的实验。(图中夹持及尾气处理装置均已略去)
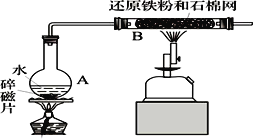
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作用是_____________________________。装置B中发生反应的化学方程式是________________________________。
(2)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法____________________________________。
Ⅱ、利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如图所示,已知两电极的材料分别为石墨和铁。
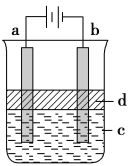
(1)a电极的材料应为__________,电极反应式为__________________。
(2)d为苯,其作用是________________。
(3)当电解一段时间后看到白色Fe(OH)2沉淀,然后向溶液中通入空气,可观察的现象是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将 1 mol 的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(l),热效应为△H 3。则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为△H 3。则下列判断正确的是( )
A. △H2>△H3
B. △H1<△H3
C. △H1+△H3=△H2
D. △H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2![]() 2NO2。其中NO的物质的量[n(NO)]随时间的变化如下表:
2NO2。其中NO的物质的量[n(NO)]随时间的变化如下表:
时间/s | 0 | 10 | 20 | 30 | 40 | 50 |
n(NO)/mol | 0.2 | 0.1 | 0.08 | 0.07 | 0.07 | 0.07 |
请回答下列问题:
(1)用O2表示达到平衡(假设30 s刚刚达到平衡)时反应速率________,0~10 s与10~20 s的反应速率之比为________。
(2)根据上述数据,能否计算800℃时该反应的平衡常数K________,“能”则计算K,“否”则说明缺少的数据:________。
(3)若升高反应体系的温度,使反应重新达到平衡,此时体系中n(NO)=n(NO2),则该反应是________热反应(选填“吸”或“放”)。
(4)在800 ℃时,若缩小容器的体积,达新平衡时n(NO)________(选填“>”、“=”或“<”)0.07 mol,NO的转化率________(选填“增大”、“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 甲苯可以与液溴混合后加入铁粉生成![]()
B. 实验室制备乙烯时,温度计水银球应该插入浓硫酸和无水乙醇的混合液液面以下
C. 向溴乙烷中加入NaOH溶液加热,充分反应,再加入AgNO3溶液,产生淡黄色沉淀,证明溴乙烷中含有溴元素
D. 制备新制Cu(OH)2悬浊液时,将4~6滴2%的NaOH溶液滴入2mL2%的CuSO4溶液中,边滴边振荡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com