
| A. | 4.08g镁铝合金中含有镁和铝的质量分别为1.92g、2.16g | |
| B. | 生成沉淀的最大质量为10.88g | |
| C. | 若白色沉淀只有Mg(OH)2,该NaOH溶液的浓度至少为0.96mol/L | |
| D. | 溶解4.08 g镁铝合金时,剩余盐酸的物质的量为0.1 mol |
分析 发生反应Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,4.48L气体是氢气,氢气的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,故参加反应的HCl的物质的量为0.2mol×2=0.4mol,溶液中n(HCl)=0.25L×2mol/L=0.5mol,大于参加反应的HCl的物质的量,故金属完全反应,反应后溶液中加入一定量烧碱溶液,生成沉淀的质量最大,则镁离子、铝离子恰好完全转化为Mg(OH)2、Al(OH)3,则m(沉淀)=m(金属)+m(OH-),由生成的氢气的物质的量,根据电子注意守恒计算n(OH-),再根据m=nM计算m(OH-),由此分析解答.
解答 解:发生反应Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,4.48L气体是氢气,氢气的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,故参加反应的HCl的物质的量为0.2mol×2=0.4mol,溶液中n(HCl)=0.25L×2mol/L=0.5mol,大于参加反应的HCl的物质的量,故金属完全反应,反应后溶液中加入一定量烧碱溶液,生成沉淀的质量最大,则镁离子、铝离子恰好完全转化为Mg(OH)2、Al(OH)3,则m(沉淀)=m(金属)+m(OH-),由生成的氢气的物质的量,根据电子注意守恒计算n(OH-),再根据m=nM计算m(OH-).
A.设镁铝的物质的量分别为xmol、ymol
$\left\{\begin{array}{l}{2x+3y=0.4}\\{24x+27y=4.08}\end{array}\right.$解得$\left\{\begin{array}{l}{x=0.08}\\{y=0.08}\end{array}\right.$,所以4.08g镁铝合金中含有镁、铝的质量分别为1.92、2.16g,故A正确;
B.根据电子注意守恒可知n(OH-)=2n(H2)=0.2mol×2=0.4mol,故沉淀的最大质量为4.08g+0.4mol×17g/mol=10.88g,故B正确;
C.Mg2+~2OH-
0.08 0.16,则NaOH至少0.16mol,据c=$\frac{n}{V}$,则浓度至少$\frac{0.16mol}{0.5L}$=0.32mol/L,故C错误;
D.4.48L气体是氢气,氢气的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,故参加反应的HCl的物质的量为0.2mol×2=0.4mol,溶液中n(HCl)=0.25L×2mol/L=0.5mol,
n剩(HCl)=0.5mol-0.4mol=0.1mol,故D正确;
故选C.
点评 本题考查混合物的有关计算,难度中等,注意从电子转移守恒计算n(OH-)是关键,题目难度中等.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、Cu2+、Sb3+ | B. | Cu2+、Ag+、Sb3+ | C. | Sb3+、Ag+、Cu2+ | D. | Ag+、Sb3+、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ${\;}_{1}^{2}$H原子中的中子数和质子数 | |
| B. | ${\;}_{18}^{36}$Ar原子中的质量数与中子数 | |
| C. | ${\;}_{4}^{8}$Be2+中的质子数和电子数 | |
| D. | ${\;}_{12}^{26}$Mg2+中的中子数和电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
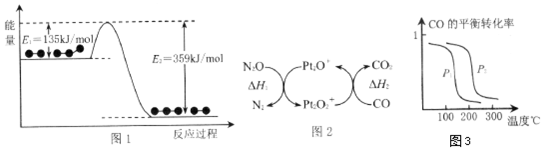
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
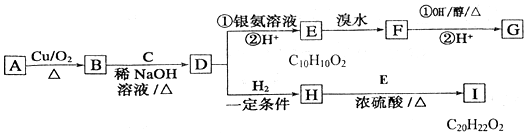
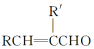 +H2O
+H2O ;E中含氧官能团的名称:羧基.
;E中含氧官能团的名称:羧基. +
+ $→_{加热}^{浓硫酸}$
$→_{加热}^{浓硫酸}$ +H2O.
+H2O.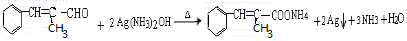 .
. .
.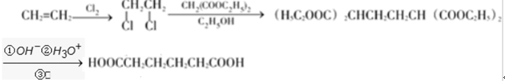 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单阳离子的氧化性:A<C | |
| B. | 可用含氧酸的酸性比较B、D元素的非金属性 | |
| C. | 简单离子半径:C>D>E>B | |
| D. | A、C、E三种元素形成的化合物既还有离子键又含有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com