
��25��Cʱ����10mL 0.0lmol�� L-1NaCN��Һ����μ���0.0lmol��L-1�����ᣬ�ζ�������ͼ1��ʾ��CN����HCNŨ����ռ����(��)��pH�仯�Ĺ�ϵ��ͼ2��ʾ�����б� ����ȷ���� 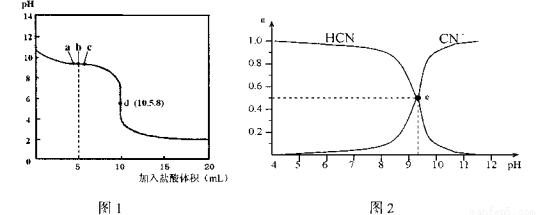
A��b��ʱ����Һ����Ũ�ȴ�С�Ĺ�ϵ��c(CN��)>c(Cl-)>c(HCN)>c<(OH��)>c(H+)
B��d ����Һ���ڵĹ�ϵ��c(Na+) + c(H+) = c(HCN) + c(OH��) + 2c(CN��)
C��ͼ2�е�e���Ӧͼ1�е�c��
D���ڵζ�������ѡ�÷�̪�Լ���ѡ�ü����Լ���ָʾ������С

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���½���³ľ����������ڶ�������Բ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���й����л����������ȷ����
A�������Ǻ��ǻ�Ϊͬ���칹�壬���ۺ���ά��Ҳ��Ϊͬ���칹��
B�����ۡ���֬�͵����ʶ��ܷ���ˮ�ⷴӦ
C�����ǡ������ʡ�֬���;۱�ϩ�����ڸ߷��ӻ�����
D�����͡����ͺ�ֲ���Ͷ���̼�⻯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱���������ظ���3��ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���е��ʻ������ʵ�������ȷ����
A��NaHSO4ˮ��Һ������
B��SiO2���ᡢ�������Ӧ
C��NO2����ˮʱ����������ԭ��Ӧ
D��Fe������Cl2��ȼ������FeCl2��FeCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱���з�ɽ������һģ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ���¶��£���6 mol C02��8 mol H2����2L�����ܱ������У��������·�Ӧ��
CO2(g) + 3H2(g)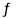 CH30H(g) + H20(g) ��H �� O
CH30H(g) + H20(g) ��H �� O
�ֱ���tʱ����ڸ�������n(H2)����ֵ���£�
t/min | 1 | 4 | 8 | 11 |
n(H2)/mol | 6 | 2.6 | 2 | 2 |
������˵����ȷ����
A�����¶��£�ƽ�ⳣ��K = 0.5
B����Ӧ����4minʱ��V��(C02) = 0.45 mol/(L��min)
C����Ӧ���е�9minʱ��H2��ת���ʱ�8minʱ��
D����Ӧ����11min��������������ѹǿ��CO2��ת����һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ̨���и���3�µ��п������ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
(15�֣����Ȼ�һ���就���ܣ�[Co(NH3)5C1]C12, M=250.5g��mol��1���Ϻ�ɫ���壩�������Ӽ�������ơ�ҽѧ����Ĺ㷺Ӧ���ܵ����ǵĹ�ע�����������Ҵ���������ˮ��ʵ�����Ʊ����Ȼ�һ���就���ܵ����̼�װ�����£�
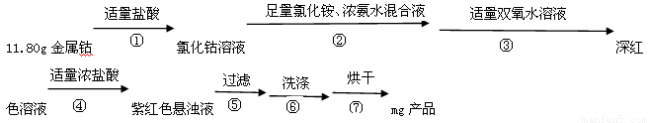
�����Ϣ��
Co+2HCl= CoCl2+ H2�� [Co(NH3)5C1]2++H2O [Co(NH3)5 H2O]3+ +Cl��
[Co(NH3)5 H2O]3+ +Cl��
(���ɫ��
��ش��������⣺
��1��д������a������_____����װ��2�м�����������رջ������еڢٲ���Ӧ�����ͨ��װ��1�жϸ÷�Ӧ�Ѿ���ȫ_____���ڲ����������Լ���ǰ���£���β����ܹ�ʵ�ֵڢڲ���Ӧ_____��
��2���ڢ۲�����˫��ˮ��������_____���ڢܲ���������Ũ�����������_____��
��3���ڢ�ϴ�Ӳ���Ϊ��������ˮϴ�ӣ������Ҵ�ϴ�ӡ������Ҵ�ϴ�ӵ�Ŀ����_____��
��4���ڢ߲���ɲ������¶�Ӧ������100-160�棬�¶Ȳ��ܹ���Ҳ���ܹ��ߵĿ���ԭ����_____��
��5������Ʒ��Ϊ10�ȷݣ�ȡ����һ����ǿ����Һ�У�������У��������а���������Һ�м����кͣ�Ȼ�����0.5000mol��L��1��KI��Һ0. 04000L(����)���μ�ָʾ������0.l000mol��L��1Na2S2O3��Һ�ζ����ﵽ�յ�����0. 1200L Na2S2O3����Һ�����ʵ��IJ���Ϊ_____��( 2Co3++2I��=2Co2++I2 �� 2S2O32��+ I2=S4O62��+2I��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ̨���и���3�µ��п������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����
A���ϳɰ���Ӧ�ڵ������ܹ��Է����У�����Ϊ��Ӧ�����֮�ʹ������������֮��
B��Ԫ�ط����ǿ���ȷ���������Ƿ���C��H��O��N��S��Cl��Br��Ԫ�أ�ԭ�����չ�����ȷ�������к�����Щ����Ԫ��
C����������Ԫ���������ڹ���Ԫ����Ѱ�Ҹ������������Ĵ������Խ��ͻ�ѧ��Ӧ�Ļ�ܣ��Ӷ��ܺõĽ���Ч��
D�����߷ֱ���ӫ�������ܹ��۲쵽���׳߶ȵ����ʣ��������Ի�õ�������Һ�еķ���ͼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�����и����ڶ���ͳһ�������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
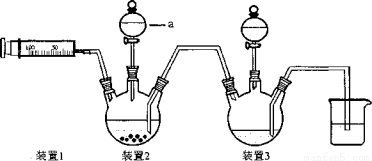
�������и�ʵ��װ�õ������У�����ȷ����

A��װ�âٿ�����ʵ������ȡ����NH3��O2
B�����ô�a����ˮ�ķ�������װ�âڵ�������
C��ʵ���ҿ���װ�â��ռ�H2��NH3
D������װ�â���������������ƣ�����bΪ�����ӽ���Ĥ��cΪ�����ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��㶫ʡ�ع��и������п������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ����ӵ���������ֵ������˵����ȷ���ǣ����ԭ��������Na=23 Fe=56 H=1 C=12 O=16 ��
A��1 mol Na2O2�����к���������Ϊ3NA
B��0.10 mol Fe��������ˮ������Ӧ���ɵ�H2������Ϊ0.10NA
C��40g NaOH����1Lˮ�У�����NaOH ��Һ�����ʵ���Ũ��Ϊ1mol/L
D����״���£�11.2 L���к��з��ӵ���ĿΪ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�ӱ�ʡ�߶�4���¿���ѧ�Ծ��������棩 ���ͣ������
(12��) ��Ҫ����ա�
��1��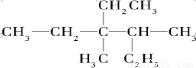 ��ϵͳ������__________��
��ϵͳ������__________��
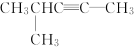 ��2��HC��CCH2CH(CH3)2ϵͳ����Ϊ_______________��
��2��HC��CCH2CH(CH3)2ϵͳ����Ϊ_______________��
��3��2��4��������Ľṹ��ʽΪ ��
��4��3-��-1-��ϩ�ļ���ʽ ��
��5��ij�߾���Ľṹ��ʽ��ͼ��ʾ��
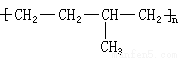
�γɸø߾���ĵ���Ľṹ��ʽ�ֱ�Ϊ �� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com