
 在含有0.4molHCl和0.1molMgSO4的混合溶液中逐滴加入Ba(OH)2 溶液,产生的沉淀质量m与加入Ba(OH)2的物质的量n之间的关系如图所示.
在含有0.4molHCl和0.1molMgSO4的混合溶液中逐滴加入Ba(OH)2 溶液,产生的沉淀质量m与加入Ba(OH)2的物质的量n之间的关系如图所示.分析 含HCl和MgSO4的混合溶液中加入Ba(OH)2后,首先发生反应Ba2++SO42-=BaSO4↓,生成既不溶于水又不溶于酸的BaSO4沉淀,同时OH-跟H+发生中和反应:OH-+H+=H2O,该阶段消耗n[Ba(OH)2]=0.1mol,则n(HCl)=2n[Ba(OH)2]=0.21mol;bc沉淀量不变,则继续发生OH-+H+=H2O,反应的盐酸为0.4mol-0.2mol=0.2mol;
cd段沉淀继续增加,发生的反应为Mg2++2OH-=Mg(OH)2↓;结合各物质的物质的量计算分析.
解答 解:含有0.4molHCl和0.1molMgSO4的混合溶液中加入Ba(OH)2后,首先发生反应Ba2++SO42-=BaSO4↓,生成既不溶于水又不溶于酸的BaSO4沉淀,同时OH-跟H+发生中和反应:OH-+H+=H2O,该阶段消耗n[Ba(OH)2]=0.1mol,则n(HCl)=2n[Ba(OH)2]=0.21mol;bc沉淀量不变,则继续发生OH-+H+=H2O,反应的盐酸为0.4mol-0.2mol=0.2mol;cd段沉淀继续增加,发生的反应为Mg2++2OH-=Mg(OH)2↓;
(1)由分析可知,a→b过程中发生反应Ba2++SO42-=BaSO4↓,OH-+H+=H2O,可以写为:Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O;
故答案为:Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O;
Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O
(2)bc沉淀量不变,则继续发生OH-+H+=H2O,故答案为:H++OH-=H2O;
(3)反应生成的沉淀为BaSO4、Mg(OH)2,则沉淀的质量为:0.1mol×233g/mol+0.1mol×58g/mol=29.1g;
故答案为:29.1.
点评 本题考查混合物计算,关键是根据沉淀变化量确定各解答发生的反应,较好的考查学生对图象与数据的分析处理能力,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:C2H4 | |
| B. | 铝的原子结构示意图: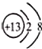 | |
| C. | H2O的结构式: | |
| D. | 硫酸钠的电离方程式:Na2SO4=2Na++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 单质的氧化性:X>R>W | |
| B. | 气态氢化物的稳定性:R<W | |
| C. | WX2和水反应形成的化合物是一定不能与铜反应 | |
| D. | 离子的氧化性:Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 假设 | B. | 实验 | C. | 做结论 | D. | 观察 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为△H=-285.5kJ•mol-1,则电解水的热化学方程式为2H2O(l)$\frac{\underline{\;电解\;}}{\;}$2H2(g)+O2(g)△H=+285.5k•Jmol-1 | |
| B. | 反应SO2(g)+2H2S(g)═3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0 | |
| C. | 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6k•Jmol-1 | |
| D. | 由C(石墨,s)=C(金刚石,s)△H=+1.90 k•Jmol-1可知,金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在食用盐中滴加少量淀粉溶液,探究食用盐是否含有IO3- | |
| B. | 新制氯水显酸性,将其滴加到紫色石蕊溶液中,充分振荡后溶液最终为无色 | |
| C. | 氯气具有漂白性,可以将湿润的有色布条漂白为无色物质 | |
| D. | 根据较强酸可以制取较弱酸的规律,结合酸性的强弱顺序H2CO3>HClO>HCO3-,可以推出少量的CO2通入NaClO溶液中能生成HClO和碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定浓度的氨水加水稀释的过程中,c(NH4+)/c(NH3•H2O)的比值减小 | |
| B. | pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)>c(CH3COO -) | |
| C. | 常温下0.4mol/LHB溶液和0.2mol/LNaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度存在下面关系:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) | |
| D. | c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c(NH4)2SO4>c(NH4Cl) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
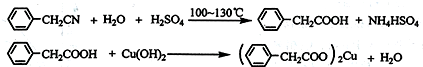

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com