
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:实验题
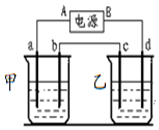 按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜和饱和氯化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】
按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜和饱和氯化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易水解产生大量白雾 ②易分解:SO2Cl2$\frac{\underline{\;△\;}}{\;}$SO2↑+Cl2↑ |
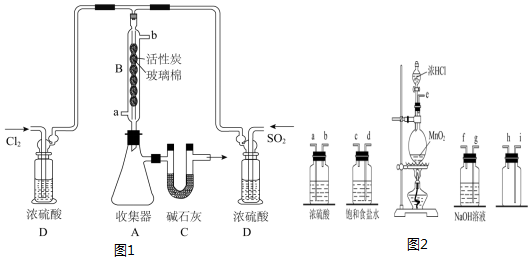
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:填空题
O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)质量之和为96克的O2和O3的气体混合,其氧原子个数为______________。
(2)现要配制1 mol·L?1 Na2CO3溶液250 mL,求:①需要固体Na2CO3_____________g;②需要含结晶水的碳酸钠晶体(Na2CO3·10 H2O) g;③需要物质的量浓度为4 mol·L?1的Na2CO3溶液 mL;④需要溶质的质量分数为12%、密度为1.12 g·cm-3的Na2CO3溶液 mL。
(3)在配制上述溶液的过程中,可能导致配制溶液浓度偏小的有:_________
A. 固体Na2CO3放在右盘(1 g以下用游码);
B. 容量瓶用碳酸钠溶液先润洗;
C. 转移溶液时未洗涤烧杯;
D. 定容时,溶液未冷却;
E. 定容时视线仰视;
F. 摇匀时,发现液面低于容量瓶刻度线,但未补加水;
G. 容量瓶未干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
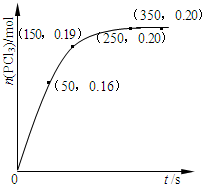 温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0mol Cl2,达到平衡时,PCl3 的转化率小于80% | |
| D. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.
1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操 作 | 溶液浓度 |
| 砝码放在左盘、NaOH固体放右盘进行称量(1g以下使用游码) | ① |
| 转移溶液时有少量液体洒落到容器外 | ② |
| 定容时俯视刻度线 | ③ |
| 摇匀后观察到液面低于刻度线,立即补充水到凹液面与刻度线水平相切 | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取3.2gNaCl固体 | B. | 用10mL量筒量取7.5mL稀盐酸 | ||
| C. | 用450mL的容量瓶配制450mL溶液 | D. | 用广泛pH试纸测得某溶液的pH为3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com