
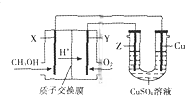
 用甲醇燃料电池电解硫酸铜溶液的装置如图所示,其中X、Y、Z均为惰性电极.甲醇在燃料电池的X电极上产生质子:CH3OH+H2O-e-→CO2+H+(未配平)经质子交换膜到达Y电极;电解一段时间后,在U型管的溶液汇总加入0.1molCu2(OH)2CO3,反应后恰好恢复为电解前的硫酸铜溶液.则下列有关说法正确的是( )
用甲醇燃料电池电解硫酸铜溶液的装置如图所示,其中X、Y、Z均为惰性电极.甲醇在燃料电池的X电极上产生质子:CH3OH+H2O-e-→CO2+H+(未配平)经质子交换膜到达Y电极;电解一段时间后,在U型管的溶液汇总加入0.1molCu2(OH)2CO3,反应后恰好恢复为电解前的硫酸铜溶液.则下列有关说法正确的是( )| A. | Y为燃料电池的正极,其电极反应为:O2+2H2O+4e-═4OH- | |
| B. | 此电解过程中,Z电极上的反应始终为:2H2O-4e-═4H++O2↑ | |
| C. | 电解过程中中铜电极不会被溶解,其原理为牺牲阳极的阴极保护法 | |
| D. | 电子沿着X→Cu→Z→Y路径移动,每个电极均通过0.6mole- |
分析 用甲醇燃料电池电解硫酸铜溶液的装置如图所示,左边为燃料原电池装置,X电极为负极,甲醇失电子发生氧化反应,反应式为CH3OH+H2O-6e-═CO2↑+6H+,Y电极为正极,氧气得电子发生还原反应,反应式为O2+4H++4e-═2H2O;右边为电解池,与X电极相连的铜为阴极,反应式先Cu2++2e-═Cu,后2H++2e-═H2↑,与Y电极相连的Z为阳极,反应式2H2O-4e-═4H++O2↑,结合电路中得失电子守恒分析.
解答 解:用甲醇燃料电池电解硫酸铜溶液的装置如图所示,左边为燃料原电池装置,X电极为负极,甲醇失电子发生氧化反应,反应式为CH3OH+H2O-6e-═CO2↑+6H+,Y电极为正极,氧气得电子发生还原反应,反应式为O2+4H++4e-═2H2O;右边为电解池,与X电极相连的铜为阴极,反应式先Cu2++2e-═Cu,后2H++2e-═H2↑,与Y电极相连的Z为阳极,反应式2H2O-4e-═4H++O2↑;
A、根据以上分析,Y电极为正极,氧气得电子发生还原反应,反应式为O2+4H++4e-═2H2O,故A错误;
B、根据以上分析,Z为阳极,反应式2H2O-4e-═4H++O2↑,故B正确;
C、与X电极相连的铜为阴极,电解过程中中铜电极不会被溶解,所以其原理为有外加电源的阴极保护法,故C错误;
D、电子从负极到正极,沿着X→Cu→Z→Y路径移动,在U型管的溶液汇总加入0.1molCu2(OH)2CO3,反应后恰好恢复为电解前的硫酸铜溶液,所以电解过程中共消耗了0.2molCuO和0.1mol水,根据电路中得失电子守恒,所以每个电极均通过0.2mol×2+0.1mol×2=0.6mole-,故D正确;
故选BD.
点评 本题考查较为综合,涉及原电池和电解池原理,为高频考点,注意电极上电极反应式的书写,抓住电路中得失电子守恒计算,难度不大.


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次增大 | |
| C. | Li、Na、K的电子层数依次增多 | |
| D. | N、O、F得电子能力依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,44.8L苯中分子数为2NA | |
| B. | 1mol水中含氢离子数为NA | |
| C. | 5.6g铁与足量稀硫酸完全反应失去电子数为0.3NA | |
| D. | 16gCH4与18gNH4+ 所含电子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | W | ||
| X | Z | Q |
| A. | X的氧化物是红宝石、蓝宝石的主要成分 | |
| B. | Q的最高价氧化物的水化物的浓溶液中只存在一种分子 | |
| C. | W的氧化物有多种,其中只有+2价的氧化物有毒,对人体有危害 | |
| D. | Z的单质可由Z的氧化物与Y的单质反应制得,说明单质Y还原性强于单质Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的乙酸、葡萄糖与淀粉完全燃烧时消耗氧气的质量相等 | |
| B. | 醇、醛和羧酸都溶于水,烃与酯的密度都小于1g/cm3 | |
| C. | 豆浆中富含大豆蛋白,煮沸后蛋白质水解成了氨基酸 | |
| D. | 某烯烃(最简式为CH2)与H2加成产物为2,3-二甲基丁烷,则该烯烃可能有2种结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 通过CO2电解固定技术有望减小室温效应并可得到多种燃料,其原因如图所示.下列说法中不正确的是( )
通过CO2电解固定技术有望减小室温效应并可得到多种燃料,其原因如图所示.下列说法中不正确的是( )| A. | 阴极区溶液pH减小 | |
| B. | 当有6.72LO2(标况下)产生时转移的电子数为1.2mol | |
| C. | 电解时,生成乙烯的电极反应式是:2CO2+12e-+12H+=C2H4+4H2O | |
| D. | 该技术中能量转化方式主要有太阳能转化为电极及电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、油脂和蛋白质都是高分子化合物 | |
| B. | 丁烷(C4H10)和二氯甲烷都存在同分异构体 | |
| C. | “地沟油”的主要成分是油脂,其类别与煤油不同 | |
| D. | 煤中含有煤焦油及多种化工原料,可通过煤的干馏获得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
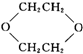 ,是一种常见的有机溶剂,它可以通过下列三步反应制得:
,是一种常见的有机溶剂,它可以通过下列三步反应制得: +2H2O,属于取代反应.
+2H2O,属于取代反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com