


科目:高中化学 来源: 题型:
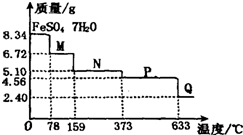 取8.34g FeS04?7H20样品加热,其受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,则下列叙述中不正确的是( )
取8.34g FeS04?7H20样品加热,其受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,则下列叙述中不正确的是( )| A、温度为78℃时固体物质M的化学式为FeSO4?4H2O | ||||
| B、温度为l59℃时固体物质N的化学式为FeSO4?H2O | ||||
C、在隔绝空气条件下,N得到P的化学方程式为:FeSO4
| ||||
| D、固体P隔绝空气加热至650℃,得到一种固体物质Q,同时有三种无色气体生成,Q的化学式为Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 模拟海水中的 离子浓度/mol?L-1 | Na+ | Mg2+ | Ca2+ | Br- | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.008 | 0.552 | 0.001 |
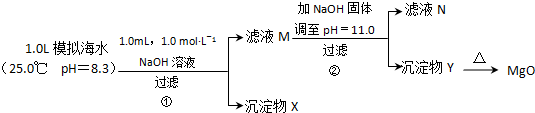
查看答案和解析>>
科目:高中化学 来源: 题型:
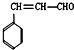 和化合物Ⅱ
和化合物Ⅱ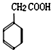 在一定条件下发生反应能生成化合物Ⅲ
在一定条件下发生反应能生成化合物Ⅲ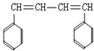 ,请回答以下问题.
,请回答以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
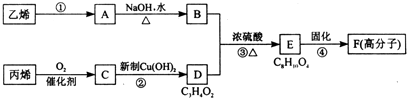
| A、反应④的反应类型是缩聚反应 |
| B、物质A是卤代烃 |
| C、物质B催化氧化后可以得到乙醛 |
| D、1 mol物质D最多可以消耗2 mol NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com