
| A. | 22.4L | B. | 44.8L | C. | 89.6L | D. | 1120L |
分析 电解饱和食盐水时,阳极上电极反应式为2Cl--2e-=Cl2↑、阴极上电极反应式为2H++2e-=H2↑,如果阴极附近产生8g气体,即产生8g氢气,n(H2)=$\frac{8g}{2g/mol}$=4mol,根据转移电子相等计算生成n(Cl2),再根据V=nVm计算生成氯气体积.
解答 解:电解饱和食盐水时,阳极上电极反应式为2Cl--2e-=Cl2↑、阴极上电极反应式为2H++2e-=H2↑,如果阴极附近产生8g气体,即产生8g氢气,n(H2)=$\frac{8g}{2g/mol}$=4mol,根据转移电子相等得生成n(Cl2)=n(H2)=4mol,V(Cl2)=nVm=4mol×22.4L/mol=89.6L,故选C.
点评 本题以电解原理为载体考查化学方程式的有关计算,明确各个电极发生的反应及转移电子守恒是解本题关键,熟练掌握物质的量有关公式,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | 所有元素中电负性最大的元素 |
| X | L层p电子数比s电子数多2个 |
| Y | 其最高价氧化物呈两性 |
| Z | L层有三个未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
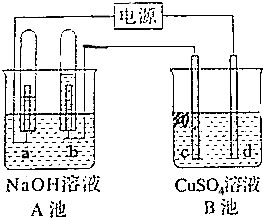 如图所示,A池用石墨电极电解pH=13的Na0H溶液100mL,B池为模拟电解精炼铜的装置,其中c电极为纯铜,d电极为粗铜(含有杂质Fe、Ag),溶液是足量CuSO4溶液,通电一段时间后停止电解,A池a极上产生的气体在标准状况下为2.24L,则下列说法正确的是( )
如图所示,A池用石墨电极电解pH=13的Na0H溶液100mL,B池为模拟电解精炼铜的装置,其中c电极为纯铜,d电极为粗铜(含有杂质Fe、Ag),溶液是足量CuSO4溶液,通电一段时间后停止电解,A池a极上产生的气体在标准状况下为2.24L,则下列说法正确的是( )| A. | d电极质量一定减少6.4g | B. | c电极质量一定增加6.4g | ||
| C. | A池pH不变 | D. | A池溶液质量减少3.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于5 s | B. | 等于10 s | C. | 大于10 s | D. | 小于10 s |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com