
下列除去杂质的方法不正确的是( )
A. 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B. 用过量氨水除去Fe3+溶液中的少量Al3+
C. 用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D. Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
考点: 物质的分离、提纯和除杂;常见金属元素的单质及其化合物的综合应用.
专题: 几种重要的金属及其化合物.
分析: A、金属镁和氢氧化钠不反应,金属铝和氢氧化钠反应生成可溶性的盐;
B、氢氧化铁和氢氧化铝沉淀均不能溶于弱碱氨水中;
C、生石灰具有吸水性,能吸收水形成氢氧化钙溶液;
D、烧碱溶液和氢氧化铝反应生成偏铝酸钠溶液,向其中通入过量的二氧化碳反应会生成氢氧化铝沉淀.
解答: 解:A、金属镁和氢氧化钠不反应,金属铝和氢氧化钠反应生成可溶性的盐,所以镁粉中混有少量铝粉,可以加入过量烧碱溶液充分反应,然后过滤、洗涤、干燥即可,故A正确;
B、Fe3+和Al3+均和氨水反应分别生成氢氧化铁和氢氧化铝沉淀,氢氧化铁和氢氧化铝沉淀均不能溶于弱碱氨水中,故不能实现,故B错误;
C、生石灰具有吸水性,能吸收水形成氢氧化钙溶液,氢氧化钙和乙醇的沸点相差较大,可以通过加热蒸馏,分离出乙醇,故C正确;
D、烧碱溶液和氢氧化铝反应生成偏铝酸钠溶液,过滤出氢氧化镁,向滤液中通入过量的二氧化碳会生成氢氧化铝沉淀,实现除杂的目的,故D正确.
故选B.
点评: 本题考查学生物质的分离和除杂的方法,要求学生掌握化学实验的基本操作知识,学以致用.


科目:高中化学 来源: 题型:
化学与生活有着密切联系,以下生活中的做法正确的是( )
A.用燃烧的方法鉴别真丝围巾和纯棉围巾
B.用铝制容器长时间存放醋、酸梅汤、碱水等
C.用福尔马林(35%~40%甲醛水溶液)浸泡海产品,防腐保鲜
D.在食品中添加大量的人工合成色素,以提高食品的营养价值
查看答案和解析>>
科目:高中化学 来源: 题型:
结合图判断,下列叙述正确的是( )
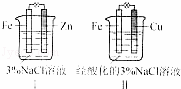
A.Ⅰ是验证牺牲阳极的阴极保护法的实验装置
B.Ⅰ和Ⅱ中负极反应均是Fe﹣2e﹣=Fe2+
C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e﹣=4OH﹣
D.Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)加入ZnO调节pH=a的目的是______________,a的范围是 。
(2)由不溶物E生成溶液D的化学方程式为____________________________。
(3)滤液A中加入H2O2反应的离子方程式为 。
(4)由溶液D制胆矾晶体包含的主要操作步骤是 。
(5)下列试剂可作为Y试剂的是______。
A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法在一定条件下可以实现的是( )
①酸性氧化物与碱反应
②弱酸与盐溶液反应可生成强酸
③没有水生成,也没有沉淀和气体生成的复分解反应
④两种酸溶液充分反应后的溶液呈中性
⑤有单质参加的非氧化还原反应
⑥两种含氧化合物反应的产物有气体.
A. ①②③④⑤⑥ B. ②④⑤⑥ C. ①②③⑤ D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是( )
A. n(Cl2):n(Fe)=5:4 5Cl2+4Fe  2FeCl2+2FeCl3
2FeCl2+2FeCl3
B. n(Cl2):n(FeBr2)=1:1 Fe2++2Br﹣+Cl2═Fe3++Br2+2Cl﹣
C. n(MnO4﹣):n(H2O2)=2:3 2MnO4﹣+3H2O2+6H+═2Mn2++4O2↑+6H2O
D. n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3﹣═3Fe2++Fe3++3NO↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是( )
|
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 |
|
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
|
| C. | 根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 |
|
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的.已知:
氧化性:IO3﹣>Fe3+>I2;还原性:S2O32﹣>I﹣
3I2+6OH﹣═IO3﹣+5I﹣+3H2O;KI+I2⇌KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①加KSCN溶液显红色,该红色物质是(用化学式表示);CCl4中显紫红色的物质 (用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为 、 .
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.
写出潮湿环境下KI与氧气反应的化学方程式: .
将I2溶于KI溶液,在低温条件下,可制得KI3•H2O.该物质作为食盐加碘剂是否合适? (填“是”或“否”),并说明理由 .
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是 .
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应不能用离子方程式CO32-+2H+=CO2↑+H2O表示的是
A.Na2CO3+2HCl=2NaCl+CO2↑+H2O B.CaCO3+2HCl=CaCl2+H2O+CO2↑
C.K2CO3+H2SO4=K2SO4+CO2↑+H2O D.K2CO3+2HNO3=2KNO3+CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com