
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:阅读理解
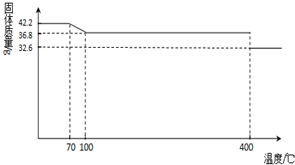 (2013?德州模拟)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O.
(2013?德州模拟)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O.查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁瓦房店高级中学高二上学期期中考试化学试卷(带解析) 题型:单选题
化学用语是学习化学的重要工具,下列化学用语中,正确的是
| A.已知:2H2(g)+O2(g) = 2H2O(g) ΔH=-483.6 kJ/mol,氢气的燃烧热为241.8 kJ/mol |
| B.在AgCl悬浊液中加入KI溶液充分振荡:Ag+ + I- = AgI↓ |
| C.某反应⊿H<0,ΔS>0,则该反应在任意条件下均可自发进行。 |
D.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S |
查看答案和解析>>
科目:高中化学 来源:2014届辽宁瓦房店高级中学高二上学期期中考试化学试卷(解析版) 题型:选择题
化学用语是学习化学的重要工具,下列化学用语中,正确的是
A.已知:2H2(g)+O2(g) = 2H2O(g) ΔH=-483.6 kJ/mol,氢气的燃烧热为241.8 kJ/mol
B.在AgCl悬浊液中加入KI溶液充分振荡:Ag+ + I- = AgI↓
C.某反应⊿H<0,ΔS>0,则该反应在任意条件下均可自发进行。
D.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com