
 两同学为制得纯净的Fe(OH)2,根据如图所示的装置,回答问题.A管中是Fe+H2SO4,B管中是NaOH溶液
两同学为制得纯净的Fe(OH)2,根据如图所示的装置,回答问题.A管中是Fe+H2SO4,B管中是NaOH溶液分析 (1)Fe和稀硫酸反应生成氢气和硫酸亚铁,生成的氢气导通过导管进入B装置,NaOH和硫酸亚铁反应生成Fe(OH)2,Fe(OH)2不稳定,易被空气氧化生成 Fe(OH)3,据此判断反应现象
(2)生成的氢气将试管B中的空气排出,夹紧止水夹a后硫酸亚铁被压入试管B中发生反应Fe2++2OH-=Fe(OH)2↓,防止氢氧化亚铁了被氧化;
(3)根据防止氢氧化亚铁被氧化需要排净试管B中空气分析;
(4)根据以上分析进行判断谁能够获得纯净的Fe(OH)2.
解答 解:(1)A中反应为Fe+H2SO4=FeSO4+H2↑,氢气的生成导致A中压强增大,溶液从导管进入试管B,发生的反应为:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,Fe(OH)2不稳定,易被空气氧化生成 Fe(OH)3,所以看到的现象是:有白色沉淀生成,迅速变成灰绿色,最终变成红褐色,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:有白色沉淀生成,迅速变成灰绿色,最终变成红褐色;
(2)先打开止水夹a,使A管中物质反应一段时间后,再夹紧止水夹,A中生成的氢气将空气排出,生成的硫酸亚铁和氢氧化钠混合时氢氧化亚铁不被氧化,即 Fe2++2OH-=Fe(OH)2↓,所以看到的现象是:有白色沉淀生成(且不变色),
故答案为:有白色沉淀生成;
(3)通过以上分析知,乙同学的实验:先打开止水夹a,使A管中物质反应一段时间后,再夹紧止水夹,这样A中生成的氢气将空气排出,可制取纯净的Fe(OH)2,
故答案为:使A管中产生的气体通入B管中赶走空气;
(4)根据分析可知,甲同学制取的氢氧化亚铁会被氧化,无法获得纯净的Fe(OH)2,而乙同学将装置中空气排净,能够获得纯净的Fe(OH)2,
故答案为:乙.
点评 本题考查了氢氧化亚铁的制备,题目难度中等,明确制备氢氧化亚铁的原理为解答关键,注意氢氧化亚铁不稳定,易被空气氧化生成氢氧化铁而变质,为制取氢氧化亚铁,需要将空气隔绝,只要不存在氧气就能制得较纯净的氢氧化亚铁,试题提高了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
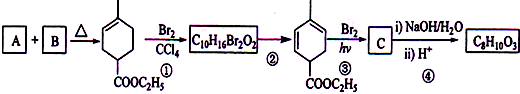
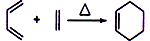
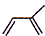 ,化学名称是2-甲基-1,3-丁二烯;
,化学名称是2-甲基-1,3-丁二烯;
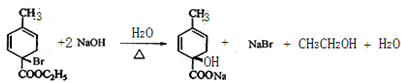 :
:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化氢是由氢气和氧气组成的 | |
| B. | 它是由2个氢元素和2个氧元素组成的 | |
| C. | 过氧化氢在二氧化锰作用下能生成水和氧气,该反应为复分解反应 | |
| D. | 每个过氧化氢分子中含有2个氢原子和2个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2S是氧化产物 | |
| B. | 14molCuSO4发生反应,有11mol电子转移 | |
| C. | FeS2中S显-2价 | |
| D. | 若有7molCuSO4发生反应,则被其氧化的S原子为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g CH4与18g NH4+所含的质子数均为10NA | |
| B. | 将15.6g Na2O2投入到足量水中,反应后溶液中的氧原子数为0.4NA | |
| C. | 在1L 0.1 mol•L-1的碳酸钠溶液中,阴离子总数一定大于0.lNA | |
| D. | 2molNO和1 mol O2混合,所得气体的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去N2中的少量O2:通过灼热的Cu粉,收集气体 | |
| B. | 除去Cl2中的少量HCl:通入饱和NaCl溶液,干燥后收集气体 | |
| C. | 除去Fe2O3固体中少量Al2O3:加入足量NaOH溶液,过滤、洗涤、干燥 | |
| D. | 除去Na2CO3溶液中的NaHCO3可采用加热的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mL pH=1的盐酸与100 mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 | |
| B. | 在滴有酚酞的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 1.0×10ˉ8mol•L-1盐酸的pH=8.0 | |
| D. | 某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
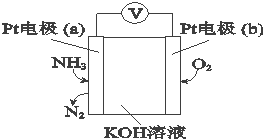
| A. | O2在电极b上发生还原反应 | |
| B. | 溶液中OH-向电极a移动 | |
| C. | 反应消耗的NH3与O2的物质的量之比为3:4 | |
| D. | 负极的电极反应式为:2NH3-6e-+6OH-═N2+6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com