
【题目】电解精炼铜的阳极泥主要成分为Cu2Te、Ag2Se和少量金属单质及其他化合物,工业上从其中回收碲、硒的一种工艺流程如下:
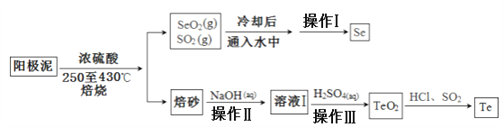
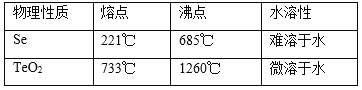
已知TeO2与Al2O3的化学性质相似,元素碲在溶液中主要以Te4+、TeO32-等形式存在;Se和TeO2的物理性质如下:
(1)加入浓硫酸焙烧前常将阳极泥中大块颗粒先粉碎其目的是______________________。
(2)上述流程中操作仅为物理分离过程,其名称为___________,SeO2与SO2在冷水中反应的化学方程式___________________________。
(3)焙砂中碲以TeO2形式存在,写出氢氧化钠溶液与TeO2反应的离子方程式___________。
(4)向溶液Ⅰ中加入硫酸时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4过量,将导致碲的回收率_____________(填“偏高”、“偏低”或“无影响”)。
(5)将纯净的TeO2先溶于盐酸得到四氯化碲,然后再通入二氧化硫得到碲单质,该过程中涉及到的反应类型有___________________________。
(6)上述流程中可循环利用的物质________(填化学式)。
【答案】 提高反应速率 过滤 SeO2+2SO2+2H2O=2H2SO4+Se ↓ TeO2+2OH-=TeO32-+H2O 偏低 复分解反应、氧化还原反应 H2SO4、HCl
【解析】以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)加入硫酸焙烧,得到SeO2、SO2,将SeO2、SO2混合气体用水吸收得到H2SO4、Se,过滤分离,滤液中含有硫酸,经过净化除杂得到Se;焙烧得到的固体中混有TeO2,TeO2是两性氧化物,微溶于水,加碱溶过滤除去杂质,得到Na2TeO3溶液,再加硫酸沉降经过滤得到TeO2沉淀,再用盐酸溶解生成四氯化碲,再用二氧化硫还原制成碲单质;
(1)通常为提高反应速率,阳极泥中大块颗粒先粉碎后,再加入浓硫酸焙烧;
(2)据分析,上述流程中操作为过滤,SeO2与SO2在冷水中反应的化学方程式SeO2+2SO2+2H2O=2H2SO4+Se↓;
(3)TeO2为两性氧化物,溶于氢氧化钠溶液生成Na2TeO3溶液,此反应的离子方程式为TeO2+2OH-=TeO32-+H2O;
(4)TeO2为两性氧化物,能溶解于稀硫酸,则如果H2SO4过量,会有部分溶解TeO2,将导致碲的回收率偏低;
(5)将纯净的TeO2先溶于盐酸得到四氯化碲,发生的反应为复分解反应,通入二氧化硫将四氯化碲还原得到碲单质,此反应为氧化还原反应;
(6)有流程分析可知SeO2、SO2混合气体用水吸收得到H2SO4、Se,四氯化碲用SO2还原得到稀盐酸,则稀H2SO4和稀HCl均可循环利用。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平。E是具有果香气味的液体。A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略)。

请回答下列问题:
(1)工业上,由石油获得石蜡油的方法是___________________。
(2)丁烷是由石蜡油获得A的过程中的中间产物之一,它的一种同分异构体中含有三个甲基(![]() ),则这种同分异构体的结构简式是:___________________; D物质中官能团的名称是_______________。
),则这种同分异构体的结构简式是:___________________; D物质中官能团的名称是_______________。
(3)A、B共0.1 mol,完全燃烧消耗O2的体积是_______(标准状况下)。
(4)反应B→C的化学方程式为______________________。
(5)反应B+D→E的化学方程式为______________________;该反应的速率比较缓慢,实验中为了提高该反应的速率,通常采取的措施有______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁屑和铜屑一起放入稀HNO3中,有少量铜屑剩余,则溶液中可能有的金属离子是( )
A.Fe3+和Cu2+
B.Fe2+和Cu2+
C.Fe2+和Fe3+
D.只有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中常见的金属防腐的方法很多.下列措施不能起到防腐的是
A. 地下钢铁管道用导线连接着铜块 B. 衣架和电线的外面包上一层塑料层
C. 在轮船船身上装上一定数量的锌块 D. 铁制健身器材刷油漆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一在空气里暴露过的KOH固体样品,经分析其含水7.65%,含K2CO34.32%,其余是KOH。若将ag样品放入bmL1mol/L的盐酸中,使其充分作用后,残酸用25.25mL,cmol/L的KOH溶液恰好中和完全。蒸发所得溶液,得到固体质量的表达式中(单位g) ( )
A. 只含有a B. 只含有 b C. 可能含有b D. 一定有a、b和c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有硫酸和盐酸的混合溶液20mL,在该溶液中滴入0.05mol/L的Ba(OH)2溶液时,生成BaSO4的质量和溶液的pH得到如图所示的结果,求:

⑴最初混合液中硫酸的物质的量浓度____________________
盐酸的物质的量浓度____________________
⑵在A点溶液的pH=____________________。
Ⅱ.Ba2+是一种重金属离子,对生物体有害,环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度。
(1)现需配制250mL0.100mol·L—1标准Na2S2O3溶液,所需要的玻璃仪器除量筒、250mL容量瓶、玻璃棒外,还需要_____________________。
(2)需准确称取Na2S2O3固体的质量为________________g。
(3)另取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。
已知有关的离子方程式为:
①Cr2O72-+6I-+14H+ 2Cr3++3I2+7H2O;
②I2+2S2O32- 2I-+S4O62-.试计算该工厂废水中Ba2+的物质的量浓度c(Ba2+)=________________________。
Ⅲ.试回答下列问题:
(1)已知24 g A和40 g B恰好完全反应生成0.4 mol C和32 g D,则C的摩尔质量为_________________。
(2)把1 mol Na和1 mol Mg分别投入到等量且过量的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为ma_____________mb。
(3)如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19 g·cm-3
HCl的质量分数:36.5%
①该浓盐酸中HCl的物质的量浓度为____________mol·L-1。
②标准状况下,1.00 L水(密度为1.00 g·cm-3)吸收_____________L的HCl可制得上述浓盐酸(保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于丙烯(CH3—CH=CH2)的说法正确的
A. 丙烯分子有8个σ键,1 个π键 B. 丙烯分子中3个碳原子都是sp3杂化
C. 丙烯分子不存在非极性键 D. 丙烯分子中所有原子都共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com