解答:
解:(1)①合成氨的化学方程式为N
2+3H
22NH
3,故答案为:N
2+3H
22NH
3;
②图表中平衡常数随温度升高减小,说明平衡逆向进行,逆向是吸热反应,正向是放热反应,故答案为:随温度升高,反应的平衡常数K减小;
③反应是N
2+3H
22NH
3,反应是气体体积减小的放热反应,为了增大平衡时H
2的转化率,平衡正向进行分析,
a.增大压强,平衡正向进行,氢气转化率增大,故a符合;
b.使用合适的催化剂,改变反应速率,不能改变平衡,氢气转化率不变,故b不符合;
c.升高温度平衡逆向进行,氢气转化率减小,故c不符合;
d.及时分离出产物中的NH
3,平衡正向进行,氢气转化率增大,故d符合;
故答案为:ad;
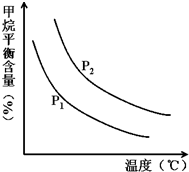
(2)①依据图象变化分析,相同温度下,CH
4(g)+H
2O (g)═CO(g)+3H
2(g),反应是气体体积增大的反应,压强越大,平衡逆向进行,甲烷平衡含量越高,所以P
2>P
1;压强一定,温度升高,甲烷平衡含量减小,平衡正向进行,正反应为吸热反应;故答案为:<;吸热;
②向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol?L
-1,
CH
4(g)+H
2O (g)?CO(g)+3H
2(g)
起始量(mol/L) 0.2 0.2 0 0
变化量(mol/L) 0.08 0.08 0.08 0.08
平衡量(mol/L) 0.12 0.12 0.108 0.08
平衡时CH
4的转化率=
×100%=40%
则该温度下反应的平衡常数K=
=0.038
故答案为:40%;0.038;
③化学平衡状态,反应的正逆反应速率相同,各成分含量保持不变分析选项,CH
4(g)+H
2O (g)?CO(g)+3H
2(g),反应后气体体积增大;
a.正反应气体体积增大,容器内压强不随时间改变,能说明反应达到平衡状态,故a符合;
b.混合气体质量守恒,容器体积不变,反应过程中和平衡状态下,混合气体的密度不随时间改变,不能说明反应达到平衡状态,故b不符合;
c.单位时间内生成amolCH
4的同时消耗amolH
2,都是逆反应速率,且不符合化学计量数之比,不能说明正逆反应速率相同,不能说明反应达到平衡状态,故c不符合;
d.混合气中各组分物质的量之比决定于反应开始时加入的多少,故d不符合;
故答案为:a.

 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:

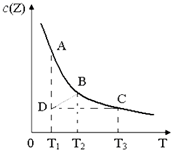 已知在一密闭容器中存在如下化学平衡:X(g)+3Y(g)?2Z(g),其中c(Z)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法中正确的是( )
已知在一密闭容器中存在如下化学平衡:X(g)+3Y(g)?2Z(g),其中c(Z)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法中正确的是( )