
分析 (1)电解溴化钾溶液生成氢氧化钾和氢气、溴单质;溴单质与二氧化硫、水反应生成硫酸和氢溴酸;
(2)依据原子个数守恒结合原子个数守恒计算生成溴单质的物质的量,依据SO2+Br2+2H2O=H2SO4+2HBr计算二氧化硫的物质的量,据此解答.
解答 解:(1)电解溴化钾溶液生成氢氧化钾和氢气、溴单质,化学方程式:2KBr+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Br2;溴单质与二氧化硫、水反应生成硫酸和氢溴酸,化学方程式:SO2+Br2+2H2O═H2SO4+2HBr;
故答案为:2KBr+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Br2;SO2+Br2+2H2O═H2SO4+2HBr;
(2)设每分钟电解KBr溶液生成Br2的物质的量为x,则:2Br-Br2 电子转移
1 mol 2 mol
x 8.56×10-11×60 mol
解得x=2.568×10-9mol;
根据SO2+Br2+2H2O=H2SO4+2HBr知SO2也为2.568×10-9 mol,故空气中SO2的含量为:
$\frac{2.568×1{0}^{-9}×64}{1.5×10{\;}^{-4}}$g•m-3=1.1×10 -3gm-3;
故答案为:$\frac{2.568×1{0}^{-9}×64}{1.5×10{\;}^{-4}}$g•m-3=1.1×10 -3gm-3;
点评 本题考查了化学方程式的书写及有关方程式的计算,明确反应实质是解题关键,注意准确把握反应物之间转化关系,依据电子转移、原子个数守恒计算,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  根据图可判断可逆反应A2(g)+3B2(g)═2AB3(g)的△H>0 | |
| B. | 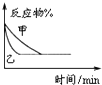 表示压强对可逆反应2A(g)+2B(g)═3C(g)+D(s)的影响,乙的压强大 | |
| C. | 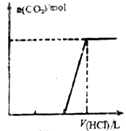 表示在含等物质的量NaOH、Na2CO3的混合溶液中逐滴加入0.1mol/L盐酸至过量时,产生气体的物质的量与消耗盐酸的体积关系 | |
| D. | 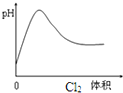 表示Cl2通入H2S溶液中pH变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | Na2B2O7 | CaF2 | H3BO3 | NH3 |
| A | 原子晶体 | 金属晶体 | 原子晶体 | 分子晶体 |
| B | 离子晶体 | 分子晶体 | 离子晶体 | 分子晶体 |
| C | 离子晶体 | 离子晶体 | 分子晶体 | 分子晶体 |
| D | 分子晶体 | 离子晶体 | 分子晶体 | 离子晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质硅是将太阳能转化为电能的常用材料 | |
| B. | 大气中SO2是形成酸雨的主要因素之一 | |
| C. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 | |
| D. | “血液透析”利用了胶体的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃料电池的正极反应式为H2+2OH--2e-═2H2O | |
| B. | 用铂电极电解硫酸铜溶液的阳极反应式为4OH--4e-═O2↑+2H2O | |
| C. | 表示醋酸与NaOH的稀溶液反应的中和热的化学方程式为H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ.mol-1 | |
| D. | NaHSO3溶于水时水解的离子方程式为HSO3-+H2O?SO32-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si可用于制造半导体材料 | |
| B. | 二氧化硫可广泛用于食品的增白 | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 84消毒液的有效成分是NaClO,可用于环境的消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y | |
| B. | 元素W最高价氧化物的水化物为强酸 | |
| C. | 化合物X2Y、Z2Y中化学键的类型相同 | |
| D. | 元素Y的简单气态氢化物的热稳定性比W的弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com