
如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是()
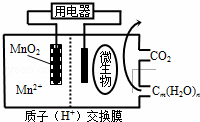
A. 分子组成为Cm(H2O)n的物质一定是糖类
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 正极反应式为:MnO2+4H++2e﹣═Mn2++2H2O
考点: 化学电源新型电池.
专题: 电化学专题.
分析: 分子组成为Cm(H2O)n的物质不一定为糖类,与甲醛、乳酸、乙酸乙酯等物质,形成原电池时,微生物所在电极区发生氧化反应,Cm(H2O)n被氧化生成水和二氧化碳,MnO2被还原生成Mn2+,为原电池的正极,放电时,阳离子向正极移动,阴离子向负极移动,以此解答.
解答: 解:A.分子组成为Cm(H2O)n的物质不一定为糖类,与甲醛、乳酸、乙酸乙酯等物质,故A错误;
B.形成原电池时,微生物所在电极区发生氧化反应,Cm(H2O)n被氧化生成水和二氧化碳,故B错误;
C.原电池工作时,阳离子向正极移动,阴离子向负极移动,故C错误;
D.MnO2被还原生成Mn2+,为原电池的正极,电极方程式为MnO2+4H++2e﹣═Mn2++2H2O,故D正确.
故选D.
点评: 本题考查新型电池,题目难度不大,注意把握原电池的工作原理以及电极反应式的书写,解答本题的关键是根据物质的性质判断原电池的正负极.


科目:高中化学 来源: 题型:
在25℃、101kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
|
| A. | ﹣488.3 kJ/mol | B. | +488.3 kJ/mol |
|
| C. | ﹣191 kJ/mol | D. | +191 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
火箭发射的燃料有很多,偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生巨大能量,可作为航天运载火箭的推动力.下列叙述中正确的是( )
A. 6.02×1023个偏二甲肼分子的质量为60g
B. 偏二甲肼的摩尔质量为60g
C. 1mol偏二甲肼的质量为60g/mol
D. 6g偏二甲肼含有NA个偏二甲肼分子
查看答案和解析>>
科目:高中化学 来源: 题型:
用18mol/L H2SO4配制90mL 1.0mol/L H2SO4,
若实验仪器有A.100m L 量筒 B.托盘天平 C.玻璃棒 D.50m L容量瓶 E.10m L量筒 F.胶头滴管 G.50m L烧杯 H.100m L 容量瓶 G.5ml量筒
(Ⅰ)实验时选用的仪器有(填序号) .
配制过程中,下列情况会使配制结果偏高的是(填序号) .
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度
(Ⅱ)在容量瓶使用方法中,下列操作不正确的是(填序号)
A.使用容量瓶前检查它是否漏水.
B.容量瓶用蒸馏水洗净后,再用待配液润洗.
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2cm处,再改用胶头滴管加蒸馏水到刻度线.
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线线1~2cm处,再改用胶头滴管加蒸馏水到刻度线.
E.定容后,盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转、摇匀.
F.如配制100mL0.200mol/L的氯化钠溶液时,可将称量的氯化钠固体溶于100mL蒸馏水中.
查看答案和解析>>
科目:高中化学 来源: 题型:
现有含CaO杂质的CaC2试样.设计以下实验,测定CaC2试样的纯度.(反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑),请从下图中选用适当的装置,完成该实验.
(1)制取C2H2最好选④中的丙,所选用装置的连接顺序是(填各接口A~E的顺序): .
(2)若实验时称取的试样为1.4g,产生的乙炔在标准状况下的体积为448mL,此试样中CaC2的质量分数为 .(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应A2(g)+2B2(g)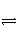
 2AB2(g) ΔH<0,下列说法正确的是( )
2AB2(g) ΔH<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
在2L的密闭容器内,800℃时反应2NO(g)+O2(g)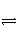
 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1) 写出该反应的平衡常数表达式:K=_____________________________________。
已知:K300℃>K350℃,则该反应是______热反应。
(2)下图表示NO2的变化的曲线是__________。用O2表示从0~2s内该反应的平均速率v=_____________________________________
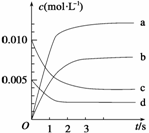
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体b.适当升高温度c.增大O2的浓度d.选择高效催化剂
附加题:
查看答案和解析>>
科目:高中化学 来源: 题型:
对可逆反应2A(s)+3B(g)C(g)+2 D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v (正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①② B.④ C.③ D.④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com