
| A. |  如果MnO2过量,浓盐酸就可全部消耗 | |
| B. |  量筒中发生了取代反应 | |
| C. |  生成蓝色的烟 | |
| D. |  干燥的有色布条褪色,说明氯气有漂白性 |
分析 A、从浓盐酸随着反应进行浓度减小后不与二氧化锰继续反应分析判断;
B、发生取代反应生成HCl,HCl极易溶于水;
C、铜在氯气中燃烧产生棕色的烟分析;
D、干燥的有色布条不褪色.
解答 解:A、如果MnO2过量,浓盐酸随着反应进行,浓度减小到一定程度,不再与二氧化锰继续反应,所以盐酸不能全部消耗,故A错误;
B、甲烷与氯气发生取代反应,生成的HCl极易溶于水,则量筒中气体颜色变浅,液面上升,故B正确;
C、铜在氯气中燃烧产生棕色的烟,故C错误;
D、干燥的有色布条不褪色,而湿润的有色布条能褪色,是因为氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,使有色布条褪色,剩余氯气通入到盛氢氧化钠溶液的烧杯中发生反应为,Cl2+2NaOH=NaCl+NaClO+H2O,将硫酸溶液滴入烧杯中,至溶液显酸性,氯化钠和次氯酸钠会发生氧化还原反应,离子方程式为Cl-+ClO-+2H+=Cl2↑+H2O,所以结果有Cl2生成,故D错误;
故选B.
点评 本题考查了实验基本操作的装置、现象、原理,主要是物质化学性质的具体应用,关键是明确氯化钠和次氯酸钠在酸溶液中的氧化还原反应.


科目:高中化学 来源: 题型:解答题
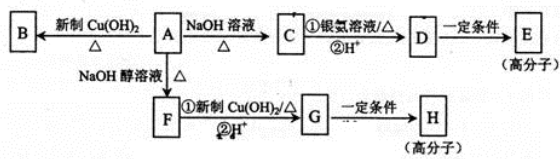
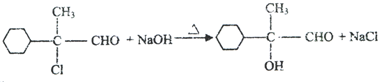 .
.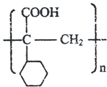 ,E的结构简式是
,E的结构简式是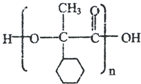 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:
某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:| 纯A(单质) | B溶液 | D固体 | G溶液 | |
| 颜色 | 银白色 | 棕黄色 | 红棕色 | 浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消除硫酸厂尾气排放:SO2+2NH3+H2O═(NH4)2SO3 | |
| B. | 消除制硝酸工业尾气的氮氧化物污染:NO+NO2+2NaOH═2NaNO2+H2O | |
| C. | 制CuSO4:Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O | |
| D. | 制CuSO4:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO CuO+H2SO4(稀)═CuSO4+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| X | Y | Z | |
| 第一电离能(KJ/mol) | 526.2 | 502.8 | 425.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列实验操作正确的是( )
下列实验操作正确的是( )| A. | 可用磨口玻璃瓶保存NaOH溶液 | |
| B. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| C. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| D. | 用装置乙加热分解NaHCO3固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com