
 .
.分析 A原子的最外层电子数是次外层电子数的3倍,最外层电子数不超过8个,所以该原子的次外层是K层,则A原子最外层有6个电子,内层有2个电子,则A是O元素;A和D同主族,且为短周期元素,D的原子序数大于A,所以D是S元素;B、C、D同周期,且B、C、D原子序数依次增大,B是短周期元素中原子半径最大的主族元素,根据元素周期律知,B是Na元素,C是地壳中含量最多的金属元素,所以C是Al,则E是Cl元素,结合元素、物质的结构和性质解答.
解答 解:(1)A的元素符号O;O与氢元素形成的氢化物中具有18电子的微粒是过氧化氢,双氧水属于共价化合物,含有2个O-H键和1个O-O键,其电子式为 ,故答案为:O;
,故答案为:O; ;
;
(2)电子层数越多半径越大,电子层相同时核电荷数越多半径越小,所以A、B、C三种元素形成的简单离子的半径由大到小的顺序是r(S2-)>r(O2-)>r(Na+)
,故答案为:r(S2-)>r(O2-)>r(Na+);
(3)过氧化钠与CO2发生氧化还原反应,生成碳酸钠和氧气,每消耗1mol CO2,转移的电子数为1NA,过氧化钠中存在离子键和非极性共价键,故答案为:1NA;在离子键和非极性共价键;
(4)SO2与氯气在水溶液中反应的化学方程式是:SO2+Cl2+2 H2O=2HCl+H2SO4,故答案为:SO2+Cl2+2 H2O=2HCl+H2SO4;
(5)氢氧化铝与足量的氢氧化钠反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(6)同周期自左而右金属性减弱,故金属性Na>Al;可以利用金属与酸、水反应剧烈程度,最高价氧化物对应的水化物的碱性强弱等判断,
a.单质熔沸点属于物理性质,不能比较金属性强弱,故a错误;
b.化合价说明最外层电子数多少,不能说明单质失去的难易程度,故b错误;
c.金属与水反应越剧烈,说明金属性越强,故c正确;
d.最高价氧化物对应的水化物的碱性越强,该元素金属性越强,故d正确,
故答案为:Na;cd.
点评 本题考查元素周期表与元素周期律,侧重对基础知识的巩固,注意掌握金属性、非金属性强弱比较实验事实.


科目:高中化学 来源: 题型:选择题
| A. | S(g)+O2(g)=SO2(g)放出热量大于297.23kJ | |
| B. | S(g)+O2(g)=SO2(g)放出热量小于297.23kJ | |
| C. | △H=-297.23kJ•mol-1表示固体S的燃烧热 | |
| D. | 形成1molSO2化学键释放的总能量大于断裂1molS(s)和1molO2(g)化学键吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
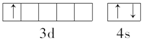 ,该元素基态原子结构示意图
,该元素基态原子结构示意图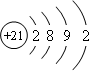 .该元素的名称为钪,形成的单质为金属晶体.
.该元素的名称为钪,形成的单质为金属晶体. 中心原子的杂化方式为
中心原子的杂化方式为查看答案和解析>>
科目:高中化学 来源: 题型:填空题
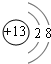 .
. ;
;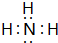 ,G的结构式为
,G的结构式为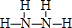 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
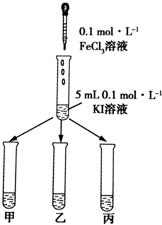 某学习小组通过下面的实验一和实验二,探究某些化学理论.
某学习小组通过下面的实验一和实验二,探究某些化学理论.| 序号 | 反应温度/℃ | C(HCl)/mol•L-1 | V(HCl)/ml | 10g碳酸钙的形状 | t/min |
| ① | 20 | 2 | 10 | 块状 | t 1 |
| ② | 20 | 4 | 10 | 块状 | t 2 |
| ③ | 20 | 2 | 10 | 粉末 | t 3 |
| ④ | 40 | 2 | 10 | 粉末 | t 4 |
| ⑤ | 40 | 4 | 10 | 粉末 | t5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅(1)(2) | B. | (1)(2)(3) | C. | (1)(2)(3)(4) | D. | 以上都不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
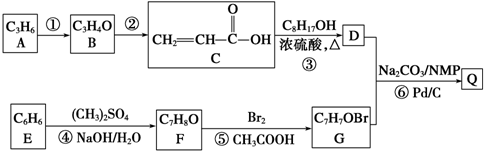
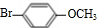 .
.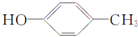 .
. +
+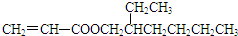 $→_{Na_{2}CO_{3}/NMP}^{Pd/C}$
$→_{Na_{2}CO_{3}/NMP}^{Pd/C}$ 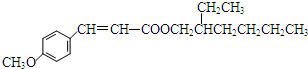 +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中溶有苯酚(浓溴水,过滤) | B. | 甲烷中含有乙烯(溴水,洗气) | ||
| C. | 乙醇中的乙酸(NaOH溶液,分液) | D. | 乙醇中含有水(金属钠,蒸馏) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com