
| A.①④ | B.②④ | C.①⑤ | D.②③ |
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝是阳极,铁是阴极 |
| B.使用NaHCO3溶液作为电解液,能减缓阴极区的pH增大 |
| C.电解液必须保持pH的相当稳定 |
| D.该电解过程中阳极反应式是:Al-3e-=Al3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
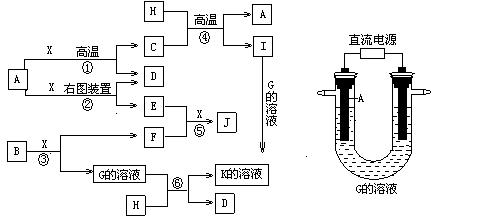
科目:高中化学 来源:不详 题型:实验题
 在工业生产和日常生活中有重要用途。 I.工业上用钛矿石(
在工业生产和日常生活中有重要用途。 I.工业上用钛矿石( ,含
,含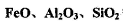 等杂质)经过下述反应制得:
等杂质)经过下述反应制得:
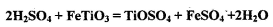
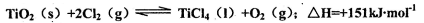
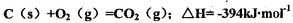
 与Cl2、C反应制取TiO4的热化学方程式:____________
与Cl2、C反应制取TiO4的热化学方程式:____________查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
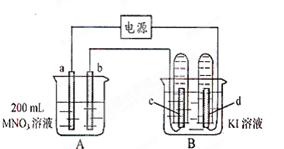

 。电解进行一段时
。电解进行一段时 也收集到了气体,此时c极上的电极反应式为: 。
也收集到了气体,此时c极上的电极反应式为: 。 溶液的物质的量浓度为 mol·L-1。
溶液的物质的量浓度为 mol·L-1。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 | B.0 | C.2 | D.13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com