

| △c |
| △t |
| △c |
| △t |
| 0.1mol/L |
| 4min |
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
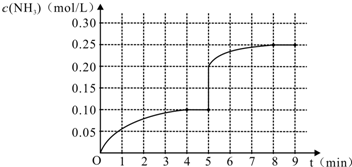 ,故答案为:
,故答案为: ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| n(CO2) |
| n(H2O) |
 的名称是
的名称是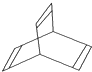
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、亚麻油酸是一种酯类 |
| B、等物质的量的两份亚麻油酸分别和Na、H2反应,消耗二者的物质的量之比为1:1 |
| C、亚麻油酸可以发生氧化、加成、水解等反应 |
| D、亚麻油酸能使溴的CCl4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③④ | C、⑤⑥ | D、⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-、Ba2-、SO42-、H+ |
| B、K+、SiO32-、H+、Cl- |
| C、Fe3+、OH-、NO3-、HCO3- |
| D、Al3+、H+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用稀盐酸清洗做焰色反应的铂丝 |
| B、金属钠保存在煤油中 |
| C、用湿润的淀粉KI试纸靠近试剂瓶口检验Cl2是否收集满 |
| D、除去粗盐溶液中的Ca2+、SO42-:先加Na2CO3溶液后加BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H2、C2H4O |
| B、C2H4、C3H6 |
| C、C2H4、C2H6O |
| D、C6H12O6、C2H4O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com